
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Уравнения химические | Уравнения (далее У) изображения реакций химических посредством знаков химических, формул химических, чисел и математических знаков. На возможность такого описания реакций указал в 1789 А. Лавуазье, основываясь на сохранения массы законе; однако всеобщее применение У получили только в 1-й половине 19 в. Каждое У состоит из двух частей – левой и правой, соединенных знаком равенства (иногда для обозначения направления реакции – простой стрелкой ®, а реакции обратимой – двойной 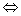 .). В левой части пишут формулы исходных веществ, в правой – формулы полученных веществ; между формулами ставят знак +. При составлении У принимают, что масса полученных веществ равна массе исходных и что число одних и тех же элементов должно быть в обеих частях У одинаковым. Перед формулами исходных и полученных веществ ставят коэффициенты, которые должны быть целыми числами. Например, зная, что при горении метана в образуются вода и двуокись можно сразу написать У этой реакции: .). В левой части пишут формулы исходных веществ, в правой – формулы полученных веществ; между формулами ставят знак +. При составлении У принимают, что масса полученных веществ равна массе исходных и что число одних и тех же элементов должно быть в обеих частях У одинаковым. Перед формулами исходных и полученных веществ ставят коэффициенты, которые должны быть целыми числами. Например, зная, что при горении метана в образуются вода и двуокись можно сразу написать У этой реакции:
4 + 22 = 22 + 2. (1)
В более сложных случаях применяют приемы, описанные в ст. Окисление-восстановление, а также способ, основанный на решении систем неопределенных уравнений. Например, требуется подобрать коэффициент У обжига пирита 2 в
x2 + y2 = 223 + t2. (2)
Очевидно, что х = 2z, t = 2x, 1y = 3z + 2t. Положив z = 1, имеем: х = 2, t = 4, у = 5,5. Умножив эти числа на 2, получаем: 42 + 112 = 223 + 82.
На основании У делаются расчеты, необходимые в лабораторной и заводской практике.
Лит.: Некрасов Б. В., Основы общей химии, 3 изд., т. 1, М., 1973.
С. А. Погодин.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 11:43:49
|

|

|
 |
|

|
 |
 |
 |
|