
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Термодинамика | Термодинамика (далее Т) наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Т строится на основе фундаментальных принципов (начал), которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел. Поэтому закономерности в соотношениях между физическими величинами, к которым приводит Т, имеют универсальный характер. Обоснование законов Т, их связь с законами движения частиц, из которых построены тела, дается статистической физикой. Последняя позволяет выяснить и границы применимости Т
Равновесные и неравновесные состояния. Равновесным является такое состояние изолированной системы, в которое она переходит по истечении, строго говоря, бесконечно большого промежутка времени. Практически равновесие достигается за конечное время (время релаксации), которое зависит от природы тел, их взаимодействий, а также и от характера исходного неравновесного состояния. Если система находится в состоянии равновесия, то в равновесии находятся и отдельные ее макроскопические части. При неизменных внешних условиях такое состояние не меняется со временем. Следует подчеркнуть, что неизменность во времени не является достаточным признаком равновесности состояния. Например, помещенный в термостат участок электрической цепи, по которому течет постоянный ток, находится в неизменном (стационарном) состоянии практически неограниченное время. Однако это состояние неравновесно: протекание тока сопровождается необратимым превращением энергии электрического тока в теплоту, отводимую в термостат, в системе имеется градиент температуры. В стационарном неравновесном состоянии могут находиться и все так называемые открытые системы.
Равновесное состояние полностью характеризуется небольшим числом физических параметров. Прежде всего, это температура, равенство значений которой для всех частей системы является необходимым условием термодинамического равновесия. (Существование температуры — параметра, единого для всех частей системы, находящейся в равновесии, часто называется нулевым началом Т) Состояние однородных жидкости или газа полностью фиксируется заданием любых двух из трех величин: температуры Т, объема и давления р. Связь между р, и Т характерна для каждой данной жидкости (газа) и называется уравнением состояния (например, Клапейрона уравнение для идеального газа или Ван-дер-Ваальса уравнение). В более сложных случаях для полной характеристики равновесного состояния могут понадобиться и др. параметры (например, концентрации отдельных составляющих смеси газов, напряженность электрического поля, индукция).
Обратимые (квазистатические) и необратимые процессы. В процессе перехода из одного равновесного состояния в другое, который может происходить под влиянием различных внешних воздействий, система проходит через непрерывный ряд состояний, не являющихся, вообще говоря, равновесными. Для реализации процесса, приближающегося по своим свойствам к равновесному, необходимо, чтобы он протекал достаточно медленно. Но сама по себе медленность процесса еще не является достаточным признаком его равновесности. Так, процесс разрядки компенсатора через большое сопротивление или дросселирование (см. Джоуля—Томсона эффект), при котором газ перетекает из одного сосуда в другой через пористую перегородку под влиянием перепада давлений, могут быть сколь угодно медленными и при этом существенно неравновесными процессами. Равновесный процесс, представляя собой непрерывную цепь равновесных состояний, является обратимым — его можно совершить в обратном направлении, и при этом в окружающей среде не останется никаких изменений. Т дает полное количественное описание обратимых процессов, а для необратимых процессов устанавливает лишь определенные неравенства и указывает направление их протекания.
Первое начало термодинамики. Существуют два принципиально различающихся способа изменения состояния системы: первый связан с работой системы по перемещению на макроскопические расстояния окружающих тел (или работой этих тел над системой); второй — с сообщением системе теплоты (или с отводом теплоты) при неизменном расположении окружающих тел. В общем случае переход системы из одного состояния в другое связан с сообщением системе некоторого количества теплоты DQ и совершением системой работы DА над внешними телами. Как показывает опыт, при заданных начальном и конечном состояниях DQ и DА существенно зависят от пути перехода. Другими словами, эти величины являются характеристиками не отдельного состояния системы, а совершаемого ею процесса. Первое начало термодинамики утверждает, что если система совершает термодинамический цикл (то есть возвращается в конечном счете в исходное состояние), то полное количество теплоты, сообщенное системе на протяжении цикла, равно совершенной ею работе.
Первое начало Т представляет собой по существу выражение закона сохранения энергии для систем, в которых существенную роль играют тепловые процессы. Энергетическая эквивалентность теплоты и работы, то есть возможность измерения их количеств в одних и тех же единицах и тем самым возможность их сравнения была доказана опытами Ю. Р. Майера (1842) и особенно Дж. Джоуля (1843). Первое начало Т было сформулировано Майером, а затем в значительно более ясной форме Г. Гельмгольцем (1847). Приведенная выше формулировка первого начала равнозначна, очевидно, утверждению о невозможности вечного двигателя 1-го рода.
Из первого начала следует, что в случае незамкнутого процесса (когда система не возвращается в исходное состояние) разность DQ — DА º D хотя и не равна, вообще говоря, нулю, но во всяком случае не зависит от пути перехода между данными состояниями. Действительно, произвольный процесс в обратном направлении образует с каждым из прямых процессов замкнутый цикл, для которого указанная разность обращается в нуль. Таким образом, D представляет собой приращение величины , имеющей в каждом состоянии вполне определенное значение, или, как говорят, являющейся функцией состояний системы. Эта величина называется внутренней энергией (или просто энергией) системы. Таким образом, из первого начала Т вытекает, что существует характеристическая функция состояния системы — ее энергия. Если речь идет об однородном теле, которое способно совершать работу только при изменении объема, то DА = pdV и бесконечно малое приращение (дифференциал) равно:
dU = dQ – pdV, (1)
где dQ — бесконечно малое приращение теплоты, не являющееся, однако, дифференциалом какой-либо функции. При фиксированном объеме (dV = 0) вся сообщаемая телу теплота идет на приращение внутренней энергии, и поэтому, в частности, теплоемкость тела при постоянном объеме cv = (dU/dT) v. Вводя другую функцию состояний = + pV (энтальпию), дифференциал которой
dH = dU + Vdp, (2)
можно получить выражение для теплоемкости, измеряемой при постоянном давлении: ср = (dH/dT) p. В случае идеального газа, который описывается уравнением состояний Клапейрона pV = nRT (n — число молей газа в объеме , R — газовая постоянная), как свободная энергия, так и энтальпия определенной массы газа зависят только от Т, что подтверждается, например, отсутствием охлаждения в процессе Джоуля — Томсона. Поэтому для идеального газа cp — cv = nR.
Второе начало термодинамики. Запрещая вечный двигатель 1-го рода, первое начало Т не исключает возможности создания такой машины непрерывного действия, которая была бы способна превращать в полезную работу практически всю подводимую к ней теплоту (так называемый вечный двигатель 2-го рода). Однако весь опыт по конструированию тепловых машин, имевшийся в начале 19 в., указывал на то, что кпд этих машин (отношение затраченной теплоты к полученной работе) всегда существенно меньше единицы: часть теплоты неизбежно рассеивается в окружающую среду. С. Карно первым показал (1824), что это обстоятельство имеет принципиальный характер, то есть любая тепловая машина должна содержать помимо нагревателя (источника теплоты) и рабочего тела, совершающего термодинамический цикл (например, пара), также и холодильник, имеющий температуру, обязательно более низкую, чем температура нагревателя. Второе начало термодинамики представляет собой обобщение вывода Карно на произвольные термодинамические процессы, протекающие в природе. Р. Клаузиус (1850) дал 2-му началу следующую формулировку: теплота не может самопроизвольно перейти от системы с меньшей температурой к системе с большей температурой. Независимо в несколько иной форме этот принцип высказал У. Томсон (Кельвин) в 1851: невозможно построить периодически действующую машину, вся деятельность которой сводилась бы к поднятию некоторого груза (совершению механической работы) и соответствующему охлаждению теплового резервуара. Несмотря на качественный характер этого утверждения, оно приводит к далеко идущим количественным следствиям.
Прежде всего оно позволяет определить максимальный кпд тепловой машины. Если машина работает на основе Карно цикла, то на протяжении изотермического контакта с нагревателем (Т = T1) рабочее тело получает количество теплоты D Q1, а на другом изотермическом участке цикла, находясь в контакте с холодильником (Т = Т2), отдает ему количество теплоты D Q2. Отношение DQ2/DQ1 должно быть одним и тем же у всех машин с обратимым циклом Карно, у которых одинаковы соответственно температуры нагревателей и холодильников, и не может зависеть от природы рабочего тела. Если бы это было не так, то машину с большей величиной указанного отношения можно было бы заставить работать в обратном направлении (поскольку циклы обратимы), приводя ее в действие с помощью машины с меньшей величиной отношения. Эта комбинированная машина обладала бы тем свойством, что в ней теплота от холодильника передавалась бы нагревателю без совершения работы. Согласно 2-му началу Т это невозможно, и поэтому отношение DQ2 /DQ1 у обеих машин должно быть одинаковым. В частности, оно должно быть тем же, что и в случае, когда рабочим телом является идеальный газ. Здесь это отношение легко может быть найдено, и, таким образом, оказывается, что для всех обратимых циклов Карно
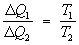 . (3) . (3)
Это выражение называется пропорцией Карно. В результате для всех машин с обратимым циклом Карно кпд максимален и равен h= (T1 — T2)/T1. В случае, если цикл необратим, то кпд оказывается меньше этой величины. Необходимо подчеркнуть, что пропорция Карно и кпд цикла Карно имеют указанный вид только в том случае, если температура измерена в абсолютной температурной шкале. Пропорция Карно положена в основу определения абсолютной температурной шкалы (см. Температурные шкалы). Следствием 2-го начала Т (пропорции Карно) является существование энтропии как функции состояний. Если ввести величину , изменение которой при изотермическом обратимом сообщении системе количества теплоты DQ есть D = DQ/T, то полное приращение в цикле Карно будет равно нулю; на адиабатических участках цикла D = 0 (так как DQ = 0), а изменения на изотермических участках компенсируют друг друга. Полное приращение оказывается равным нулю и при осуществлении произвольного обратимого цикла, что доказывается разбиением цикла на последовательность бесконечно тонких циклов Карно (с малыми изотермическими участками). Отсюда следует (как и в случае внутренней энергии), что энтропия является функцией состояния системы, то есть изменение энтропии не зависит от пути перехода. Используя понятие энтропии, Клаузиус (1876) показал, что исходная формулировка 2-го начала Т полностью эквивалентна следующей: существует функция состояния системы, ее энтропия , приращение которой при обратимом сообщении системе теплоты равно
dS = dQ/T; (4)
при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимальное значения в состоянии равновесия.
Термодинамические потенциалы. Определение энтропии позволяет написать следующие выражения для дифференциалов внутренней энергии и энтальпии:
dU = TdS – pdV, dH = TdS + Vdp. (5)
Отсюда видно, что естественными независимыми параметрами состояния для функций и Н являются соответственно пары , и , р. Если же вместо энтропии в качестве независимого параметра используется температура, то для описания системы более удобны свободная энергия (Гельмгольцева энергия, или изохорно-изотермический потенциал) = — TS (для переменных Т и ) и термодинамический потенциал G = Н — TS для переменных Т и р (Гиббсова энергия, или изобарно-изотермический потенциал), дифференциалы которых равны
dF = – SdT – pdV, dG = –SdT + Vdp. (6)
Функции состояний , Н, и G называются потенциалами термодинамическими системы для соответствующих пар независимых переменных. Метод термодинамических потенциалов (Дж. Гиббс, 1874—1878), основанный на совместном применении 1-го и 2-го начал Т, позволяет получить ряд важных термодинамических соотношений между различными физическими свойствами системы. Так, использование независимости вторых смешанных производных от порядка дифференцирования приводит к связи между теплоемкостями ср и cv, коэффициентом теплового расширения 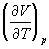 и изотермическим коэффициентом сжатия и изотермическим коэффициентом сжатия 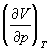
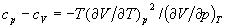
к соотношению между изотермическим и адиабатическим коэффициентами сжатия 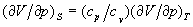 и т. п. Из условия, что изолированная система в равновесном состоянии обладает максимальным значением энтропии, вытекает условие минимальности термодинамических потенциалов в равновесном состоянии по отношению к произвольным малым отклонениям от равновесия при фиксированных значениях соответствующих независимых переменных. Это приводит к важным неравенствам (условиям устойчивости), в частности и т. п. Из условия, что изолированная система в равновесном состоянии обладает максимальным значением энтропии, вытекает условие минимальности термодинамических потенциалов в равновесном состоянии по отношению к произвольным малым отклонениям от равновесия при фиксированных значениях соответствующих независимых переменных. Это приводит к важным неравенствам (условиям устойчивости), в частности
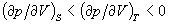 , cp > cv > 0 (см. Устойчивость термодинамическая). , cp > cv > 0 (см. Устойчивость термодинамическая).
Третье начало термодинамики. Энтропия определяется согласно 2-му началу Т дифференциальным соотношением (4), то есть определяется с точностью до постоянного слагаемого, которое хотя и не зависит от температуры, но могло бы быть различным для разных тел в состоянии равновесия. Соответствующие неопределенные слагаемые существуют и у термодинамических потенциалов. В. Нернст (1906) на основе своих электрохимических исследований пришел к выводу, что эти слагаемые должны быть универсальными: они не зависят от давления, агрегатного состояния и других характеристик вещества. Этот новый, следующий из опыта принцип обычно называется третьим началом термодинамики или тепловой теоремой Нернста. М. Планк (1911) показал, что оно равносильно условию: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения к абсолютному нулю температуры, поскольку универсальную константу в энтропии можно положить равной нулю. Из 3-го начала Т следует, в частности, что коэффициент теплового расширения, изохорный коэффициент давления 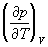 и удельные теплоемкости cp и cv обращаются в нуль при T®0. Необходимо отметить, что 3-е начало Т и вытекающие из него следствия не относятся к системам, находящимся в так называемом заторможенном состоянии. Примером такой системы является смесь веществ, между которыми возможны реакции, но они заторможены — скорость реакций при низких температурах очень мала. Другим примером может служить быстро замороженный раствор, который при низкой температуре должен был бы расслоиться на фазы, но процесс расслоения при низких температурах практически не происходит. Такие состояния во многих отношениях подобны равновесным, однако их энтропия не обращается в нуль при Т = 0. и удельные теплоемкости cp и cv обращаются в нуль при T®0. Необходимо отметить, что 3-е начало Т и вытекающие из него следствия не относятся к системам, находящимся в так называемом заторможенном состоянии. Примером такой системы является смесь веществ, между которыми возможны реакции, но они заторможены — скорость реакций при низких температурах очень мала. Другим примером может служить быстро замороженный раствор, который при низкой температуре должен был бы расслоиться на фазы, но процесс расслоения при низких температурах практически не происходит. Такие состояния во многих отношениях подобны равновесным, однако их энтропия не обращается в нуль при Т = 0.
Применение термодинамики. Важными областями применения Т являются теория равновесия химического и теория фазового равновесия, в частности равновесия между разными агрегатными состояниями и равновесия при расслоении на фазы смесей жидкостей и газов. В этих случаях в процессе установления равновесия существенную роль играет обмен частицами вещества между разными фазами, и при формулировке условий равновесия используется понятие химического потенциала. Постоянство потенциала заменяет условие постоянства давления, если жидкость или газ находятся во внешнем поле, например поле тяжести. Методы Т эффективно применяются при изучении тех явлений природы, в которых существенную роль играют тепловые эффекты. В Т принято выделять разделы, относящиеся к отдельным наукам и к технике ( Т, техническая Т и т. д.), а также к различным объектам исследования (Т упругих тел, Т диэлектриков, магнетиков, сверхпроводников, плазмы, излучения, атмосферы, воды и др.).
Выяснение статистической природы энтропии привело к построению термодинамической теории флуктуаций (А. Эйнштейн, 1910) и к развитию термодинамики неравновесных процессов.
Лит.: Зоммерфельд А., Т и статистическая физика, М., 1955; Леонтович М. А., Введение в термодинамику, 2 изд., М.—Л., 1952; Ландау Л. Д., Лифшиц Е. М., Статистическая физика, 2 изд., М., 1964 (Теоретическая физика, т. 5); Второе начало термодинамики. Сб., М.—Л., 1934; Эпштейн П. С., Курс термодинамики, пер. с англ., М.—Л., 1948; Ван-дер-Ваальс И. Д., Констамм Ф., Курс термостатики, пер. с нем., М., 1936; Кубо Р., Т, пер. с англ., М., 1970; Т. Терминология. Сб., М., 1973.
Г. М. Элиашберг. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 11:38:50
|

|

|
 |
|

|
 |
 |
 |
|