
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Свинец | (далее С)(лат. Plumbum), , элемент группы периодической системы номер 82, масса 207,2. С - тяжелый металл голубовато-серого цвета, очень пластичный, мягкий (режется ножом, царапается ногтем). Природный С состоит из 5 стабильных изотопов с массовыми числами 202 (следы), 204 (1,5%), 206 (23,6%), 207 (22,6%), 208 (52,3%). Последние три изотопа - конечные продукты радиоактивных превращений 238, 235 и 232 (см. Радиоактивные ряды). При ядерных реакциях образуются многочисленные радиоактивные изотопы С Историческая справка. С был известен за 6-7 тыс. лет до н. э. народам Месопотамии, Египта и других стран древнего мира. Он служил для изготовления статуй, предметов домашнего обихода, табличек для письма. Римляне пользовались трубами для водопроводов. Алхимики называли С сатурном и обозначали его знаком этой планеты (см. Знаки химические). Соединения С - "свинцовая зола" , белила 23• ()2 применялись в Древней Греции и Риме как составные части лекарств и красок. Когда было изобретено огнестрельное оружие, С начали применять как материал для пуль. Ядовитость С отметили еще в 1 в. н. э. греческий врач Диоскорид и Плиний Старший, Распространение в природе. Содержание С в земной коре (кларк) 1,6·10-3% по массе. Образование в земной коре около 80 минералов, содержащих С (главный из них галенит ), связано в основном с формированием гидротермальных месторождений (см. Полиметаллические руды). В зонах окисления полиметаллических руд образуются многочисленные (около 90) вторичные минералы: сульфаты (англезит 4), карбонаты (церуссит 3), фосфаты (пироморфит 5(4)3). В биосфере С в основном рассеивается, его мало в живом веществе (5·10-5%), морской воде (3·10-9%). Из природных вод С отчасти сорбируется глинами и осаждается сероводородом, поэтому он накапливается в морских илах с сероводородным заражением и в образовавшихся из них черных глинах и сланцах, Физические и свойства. С в гранецентрированной кубической решетке (а = 4,9389 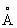 ), аллотропических модификаций не имеет. радиус 1,75 ), аллотропических модификаций не имеет. радиус 1,75 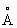 , ионные радиусы: 2+ 1,26 , ионные радиусы: 2+ 1,26 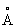 , 4+ 0,76 , 4+ 0,76 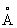 : плотность 11,34 г/см3 (20°С); tnл 327,4 °С; tkип 1725 °С; удельная теплоемкость при 20°С 0,128 кдж/(кг·К) (0,0306 кал/г·°С); теплопроводность 33,5 вт/(м·К)(0,08 кал/(см·сек·оС)); температурный коэффициент линейного расширения 29,1·10-6 при комнатной температуре; твердость по Бринеллю 25-40 Мн/м2 (2,5-4 кгс/мм2); предел прочности при растяжении 12-13 Мн/м2, при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50-70%. Наклеп не повышает механических свойств С т. к. температура его рекристаллизации лежит ниже комнатной (около -35 °С при степени деформации 40% и выше). С диамагнитен, его восприимчивость - 0,12·10-6. При 7,18 К становится сверхпроводником. : плотность 11,34 г/см3 (20°С); tnл 327,4 °С; tkип 1725 °С; удельная теплоемкость при 20°С 0,128 кдж/(кг·К) (0,0306 кал/г·°С); теплопроводность 33,5 вт/(м·К)(0,08 кал/(см·сек·оС)); температурный коэффициент линейного расширения 29,1·10-6 при комнатной температуре; твердость по Бринеллю 25-40 Мн/м2 (2,5-4 кгс/мм2); предел прочности при растяжении 12-13 Мн/м2, при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50-70%. Наклеп не повышает механических свойств С т. к. температура его рекристаллизации лежит ниже комнатной (около -35 °С при степени деформации 40% и выше). С диамагнитен, его восприимчивость - 0,12·10-6. При 7,18 К становится сверхпроводником.
Конфигурация внешних электронных оболочек 6s2 6р2, в соответствии с чем он проявляет степени окисления +2 и +4. С сравнительно мало активен Металлический блеск свежего разреза С постепенно исчезает на воздухе вследствие образования тончайшей пленки , предохраняющей от дальнейшего окисления. С образует ряд окислов 2, , 2, 34 и 23 (см. Свинца окислы).
В отсутствие 2 вода при комнатной температуре на С не действует, но он разлагает горячий водяной пар с образованием окиси С и Соответствующие окислам и 2 гидроокиси ()2 и ()4 имеют амфотерный характер.
Соединение С с 4 получается в небольших количествах при действии разбавленной соляной кислоты на 2. 4 - бесцветный газ, который очень легко разлагается на и 2. При нагревании С соединяется с галогенами, образуя галогениды PbX2 (X - галоген). Все они малорастворимы в воде. Получены также галогениды PbX4: тетрафторид 4 - бесцветные и тетрахлорид 4 - желтая маслянистая жидкость. Оба соединения легко разлагаются, выделяя 2 или 2; гидролизуются водой. С С не реагирует. Азид свинца (3)2 получают взаимодействием растворов азида 3 и солей (); бесцветные игольчатые труднорастворимые в воде; при ударе или нагревании разлагается на и 2 со взрывом. Сера действует на С при нагревании с образованием сульфида - черного аморфного порошка. Сульфид может быть получен также при пропускании сероводорода в растворы солей (); в природе встречается в виде блеска - галенита.
В ряду напряжений стоит выше (нормальные электродные потенциалы соответственно равны - 0,126 в для Û 2++ 2e и + 0,65 в для Û 4++ 4e). Однако С не вытесняет из разбавленной соляной и серной кислот, вследствие перенапряжения 2 на , а также образования на поверхности металла защитных пленок труднорастворимых 2 и сульфата 4. Концентрированные 24 и при нагревании действуют на , причем получаются растворимые комплексные соединения состава (4)2 и 2(4). уксусная, а также некоторые органические кислоты (например, лимонная) растворяют С с образованием солей (). По растворимости в воде соли делятся на растворимые (ацетат, нитрат и малорастворимые ( и и нерастворимые (сульфат, карбонат, фосфат, молибдат и сульфид). Соли () могут быть получены электролизом сильно подкисленных 24 растворов солей (); важнейшие из солей () - сульфат (4)2 и ацетат (232)4. Соли () склонны присоединять избыточные отрицательные ионы с образованием комплексных анионов, например плюмбатов (3)2- и (4)4-, (6)2-, гидроксоплюмбатов ( ()6)2- и др. Концентрированные растворы едких щелочей при нагревании реагируют с с выделением и гидроксоплюмбитов типа X2( ()4).
Получение. Металлический С получают окислительным обжигом с последующим восстановлением до сырого ("веркблея") и рафинированием (очисткой) последнего. Окислительный обжиг концентрата ведется в агломерационных ленточных машинах непрерывного действия (см. Агломерация). При обжиге преобладает реакция: 2 + 32 = 2 + 22. Кроме того, получается и немного сульфата 4, который переводят в силикат 3, для чего в шихту добавляют кварцевый песок. Одновременно окисляются и сульфиды других металлов (, , ), присутствующие как примеси. В результате обжига вместо порошкообразной смеси сульфидов получают агломерат - пористую спекшуюся сплошную массу, состоящую преимущественно из окислов , , , 23. Куски агломерата смешивают с коксом и известняком и эту смесь загружают в ватержакетную печь, в которую снизу через трубы ("фурмы") подают воздух под давлением. Кокс и окись восстанавливают до уже при невысоких температурах (до 500 °С). При более высоких температурах идут реакции:
3 = + 2
23 + 2 + С = 2 + 23 + 2.
Окислы и частично переходят в 3 и 3, которые вместе с 3 образуют шлак, всплывающий на поверхность. Окислы С восстанавливаются до металла. Сырой С содержит 92-98% , остальное - примеси , (иногда ), , , , , , . Примеси и удаляют зейгерованием. Для удаления , , через расплавленный металл продувают воздух. Выделение (и ) производится добавкой , который образует "цинковую пену", состоящую из соединений c (и ), более легких, чем , и плавящихся при 600-700 °С Избыток удаляют из расплавленного пропусканием воздуха, водяного пара или Для очистки от к жидкому добавляют или , дающие трудноплавкие соединения 32 и 32. Рафинированный этими способами С содержит 99,8-99,9% . Дальнейшая очистка производится электролизом, в результате чего достигается чистота не менее 99,99%. Применение. С широко применяют в производстве аккумуляторов, используют для изготовления заводской аппаратуры, стойкой в агрессивных газах и жидкостях. С сильно поглощает g-лучи и рентгеновские лучи, благодаря чему его применяют как материал для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура рентгеновских кабинетов и др.). Большие количества С идут на изготовление оболочек электрических кабелей, защищающих их от коррозии и механических повреждений. На основе С изготовляют многие свинцовые сплавы. Окись С вводят в хрусталь и оптическое стекло для получения материалов с большим показателем преломления. Сурик, (желтый крон) и основной карбонат С ( белила) - ограниченно применяемые пигменты. С - окислитель, используется в аналитической химии. Азид и стифнат (тринитрорезорцинат) - инициирующие взрывчатые вещества. Тетраэтилсвинец - антидетонатор. Ацетат С служит индикатором для обнаружения 2. В качестве изотопных индикаторов используются 204 (стабильный) и 212 (радиоактивный).
С А. Погодин.
С в организме. Растения поглощают С из почвы, воды и атмосферных выпадений. В организм человека С попадает с пищей (около 0,22 мг), водой (0,1 мг), пылью (0,08 мг). Безопасный суточный уровень поступления С для человека 0,2-2 мг. Выделяется главным образом с калом (0,22-0,32 мг), меньше с мочой (0,03-0,05 мг). В теле человека содержится в среднем около 2 мг С (в отдельных случаях - до 200 мг). У жителей промышленно развитых стран содержание С в организме выше, чем у жителей аграрных стран, у горожан выше, чем у сельских жителей. Основное депо С - скелет (90% всего С организма): в печени накапливается 0,2-1,9 мкг/г; в крови - 0,15-0,40 мкг/мл; в волосах - 24 мкг/г, в молоке -0,005-0,15 мкг/мл; содержится также в поджелудочной почках, головном мозге и др. органах. Концентрация и распределение С в организме животных близки к показателям, установленным для человека. При повышении уровня С в окружающей среде возрастает его отложение в костях, волосах, печени. Биологические функции С не установлены.
Ю. И. Раецкая.
Отравления С и его соединениями возможны при добыче руд, выплавке С при производстве красок, в полиграфии, гончарном, кабельном производствах, при получении и применении тетраэтилсвинца и др. Бытовые отравления возникают редко и наблюдаются при употреблении в пищу продуктов, которые длительно хранили в глиняной посуде, покрытой глазурью, содержащей сурик или глет. С и его неорганические соединения в виде аэрозолей проникают в организм в основном через дыхательные пути, в меньшей степени - через желудочно-кишечный тракт и кожу. В крови С циркулирует в виде высокодисперсных коллоидов - фосфата и альбумината. Выделяется С в основном через кишечник и почки. В развитии интоксикации играют роль нарушение порфиринового, углеводного и фосфатного обменов, дефицит витаминов С и 1, функциональные и органические изменения центральной и вегетативной нервной системы, токсическое влияние С на костный мозг. Отравления могут быть скрытыми (т. н. носительство), протекать в легкой, средней тяжести и тяжелой формах.
Наиболее частые признаки отравления С кайма (полоска лиловато-аспидного цвета) по краю десен, землисто-бледная окраска кожных покровов; ретикулоцитоз и другие изменения крови, повышенное содержание порфиринов в моче, наличие в моче С в количествах 0,04-0,08 мг/л и более и т. д. Поражение нервной системы проявляется астенией, при выраженных формах - энцефалопатией, параличами (преимущественно разгибателей кисти и пальцев рук), полиневритом. При т. н. колике возникают резкие схваткообразные боли в животе, запор, продолжающиеся от нескольких ч до 2-3 нед; нередко колика сопровождается тошнотой, рвотой, подъемом артериального давления, температуры тела до 37,5-38 °С При хронической интоксикации возможны поражения печени, сердечно-сосудистой системы, нарушение эндокринных функций (например, у женщин - выкидыши, дисменорея, меноррагии и др.). Угнетение иммунобиологической реактивности способствует повышенной общей заболеваемости.
Лечение: специфические (комплексонообразователи и др.) и общеукрепляющие ( витамины и др.) средства, физиотерапия, санаторно-курортное лечение (Пятигорск, Мацеста, Серноводск). Профилактика: замена С менее токсичными веществами (например, и белила вместо автоматизация и механизация операций в производстве С эффективная вытяжная вентиляция, индивидуальная защита рабочих, лечебное питание, периодическая витаминизация, предварительные и периодические медицинские осмотры.
Препараты С используют в медицинской практике (только наружно) как вяжущие и антисептические средства. Применяют: воду (при воспалительных заболеваниях кожи и слизистых оболочек), простой и сложный пластыри (при гнойно-воспалительных заболеваниях кожи, фурункулах) и др.
Л. А. Каспаров.
Лит.: Андреев В. М., в кн.: Краткая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Чижиков Д. М., Металлургия в кн.: Справочник металлурга по цветным металлам, т. 2, М., 1947; Вредные вещества в промышленности, под ред. Н. В. Лазарева, 6 изд., ч. 2, Л., 1971; Тарабаева Г. И., Действие на организм и лечебно-профилактические мероприятия, А.-А., 1961; Профессиональные болезни, 3 изд., М., 1973,
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 12:05:22
|

|

|
 |
|

|
 |
 |
 |
|