
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Окисление - восстановление | Окисление-восстановление (далее О), окислительно-восстановительные реакции, реакции, сопровождающиеся изменением окислительных чисел Первоначально (со времени введения в химию теории горения А. Лавуазье, конец 18 в.) окислением назывались только реакции соединения с восстановлением — отнятие С введением в химию электронных представлений (1920—30) оказалось возможным широко обобщить понятие О.-в. и распространить его на реакции, в которых не участвует. Согласно электронной теории, окислением называется отдача электронов молекулой или ионом: – 2 = 2+. = 2+.
Восстановлением называется присоединение электронов молекулой или ионом: 2 + 2 = 2–. = 2–.
Окислителями называется нейтральный молекула или ион, принимающие электроны (во втором примере молекула 2), восстановителями — нейтральный молекула или ион, отдающие электроны (в первом примере — ). Окисление и восстановление — взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Так, приведенные выше частные реакции окисления и восстановления составляют единый процесс О.-в.: + 2 = 2.
Здесь окисляется до 2+, а 2 восстанавливается до 2–.
В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространенных. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов)
+ 2 = + 2,
2КВг + 2 = 2 + 2.
В основе технического производства таких важнейших продуктов, как аммиак, азотная кислота, серная кислота, процессов сжигания топлива и горения также лежат реакции О.-в. В гальванических элементах (см. Химические источники тока) возникновение электродвижущей силы обусловлено протеканием реакции О.-в. При проведении электролиза на аноде происходит электрохимическое окисление, на катоде — электрохимическое восстановление. Например, при производстве электролизом раствора на аноде идет реакция – – 1 = 1/22 (окисление аниона –), на катоде Н+ + 1 = 1/22 (окисление аниона –), на катоде Н+ + 1 =1/2Н2 (восстановление катиона Н+). Коррозия металлов также связана с реакциями О.-в. и заключается в окислении металлов. =1/2Н2 (восстановление катиона Н+). Коррозия металлов также связана с реакциями О.-в. и заключается в окислении металлов.
Дыхание, усвоение растениями углекислого газа с выделением (см. Фотосинтез), обмен веществ и др. биологически важные явления представляют собой реакции О.-в. (см. Окисление биологическое).
При составлении уравнений реакций О.-в. основная трудность заключается в подборе коэффициентов, особенно для реакций с участием соединений, в которых связь носит не ионный, а ковалентный характер. В этом случае полезны понятия электроотрицательности и окислительного числа (степени окисления). Электроотрицательность — способность в молекуле притягивать и удерживать около себя электроны. Степень окисления — такой заряд, который возник бы на в молекуле, если бы каждая пара электронов, связывающая его с др. была полностью смещена к более электроотрицательному (см. Валентность). Нахождение степени окисления в молекуле основано на том, что молекула в целом должна быть электрически нейтральной. При этом учитывается, что степень окисления некоторых элементов в соединениях всегда постоянна (щелочные металлы +1, щелочноземельные металлы и +2, +3, кроме перекисей, –2 и т.д.). Степень окисления в простых веществах равна нулю, а одноатомного иона в ионном соединении равна заряду этого иона. Например, рассчитаем степень окисления в соединении 227. Пользуясь постоянными значениями степеней окисления для К и О, имеем 2·(+1) + 7·(–2) = –12. Следовательно, степень окисления одного (чтобы сохранить электронейтральность молекулы) равна +6. На основе введенных понятий можно дать другое определение О.-в.: окислением называется увеличение степени окисления, восстановлением называется понижение степени окисления.
Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (2– – 2 = °), положительно заряженные ионы металлов в низшей степени окисления ( = °), положительно заряженные ионы металлов в низшей степени окисления (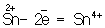 ), сложные ионы и молекулы, содержащие в промежуточной степени окисления ( ), сложные ионы и молекулы, содержащие в промежуточной степени окисления (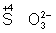 , , 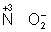 ). В промышленности и технике широко используются такие восстановители, как и окись (восстановление металлов из окислов) ). В промышленности и технике широко используются такие восстановители, как и окись (восстановление металлов из окислов)
+ С = + СО, +СО = + СО2.
сульфит 23 и гидросульфит 3 — в фотографии и красильном деле, металлический и свободный — для получения чистых металлов
4 + 4 = + 4,
2 +2Н2 = + 22.
Окислителями могут быть нейтральные неметаллов (в особенности галогенов и положительно заряженные ионы металлов в высшей степени окисления (4+ + 2 = 2+), сложные ионы и молекулы, содержащие элементов в более высокой степени окисления ( = 2+), сложные ионы и молекулы, содержащие элементов в более высокой степени окисления (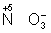 , ,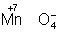 , ,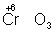 ). Промышленное значение как окислители имеют: (особенно в металлургии), озон, и двухромовая кислоты и их соли, кислота, перекись перманганат известь и др. Самый сильный окислитель — электрический ток (окисление происходит на аноде). ). Промышленное значение как окислители имеют: (особенно в металлургии), озон, и двухромовая кислоты и их соли, кислота, перекись перманганат известь и др. Самый сильный окислитель — электрический ток (окисление происходит на аноде).
Для подбора коэффициентов в уравнениях реакций О.-в. служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод.
В методе электронного баланса подсчет числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
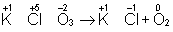
Таким образом, 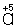 является окислителем, а является окислителем, а 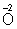 — восстановителем. Составляют частные реакции окисления и восстановления: — восстановителем. Составляют частные реакции окисления и восстановления:
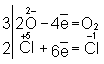
В соответствии с приведенным выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
23 = 2 + 32.
В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки — в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например,
4 + + 24 ® 24 + 2+ 4 + 2,
в ионном виде:
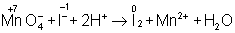
Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления:
2– – 2 = 2, = 2,
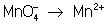
Во втором уравнении, перед тем как записать переход электронов, необходимо составить "материальный" баланс, т.к. в левой части уравнения есть О, а в правой их нет. Избыточные О связываются в молекулы воды ионами Н+, присутствующими в сфере реакции (кислая среда):
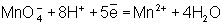
Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведенном примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
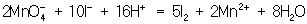 . .
Полученные коэффициенты подставляют в исходное уравнение:
24 + 10 + 824 = 624 + 52 + 24 + 82.
Аналогично составляют и уравнения реакций О.-в. в щелочной среде (вместо ионов Н+ в частных уравнениях фигурируют ионы –). Т. о., в уравнивании реакций по второму методу учитывают характер реакционной среды (кислая или щелочная либо нейтральная), которая сильно влияет и на направление реакции О.-в. и на продукты, получаемые в результате реакции. Например, равновесие окислительно-восстановительной реакции 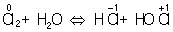 в кислой среде смещено влево, а в щелочной — вправо. Сильный окислитель ион в кислой среде смещено влево, а в щелочной — вправо. Сильный окислитель ион 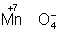 в кислой среде восстанавливается до иона 2+, в щелочной среде — до иона в кислой среде восстанавливается до иона 2+, в щелочной среде — до иона 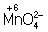 , в нейтральной — до молекулы , в нейтральной — до молекулы 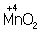 . См. также Окисление металлов, Восстановление металлов. . См. также Окисление металлов, Восстановление металлов.
Лит.: Кудрявцев А. А., Составление уравнений, М., 1968; Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12.
В. К. Бельский.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 12:16:27
|

|

|
 |
|

|
 |
 |
 |
|