
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Комплексные соединения | Комплексные соединения (далее К) координационные соединения, соединения, состав которых не укладывается в рамки представлений об образовании связей за счет неспаренных электронов. Обычно более сложные К образуются при взаимодействии простых соединений. Так, при взаимодействии цианистых солей и образуется К — ферроцианид ()2 + 4 = 4( ()6). К широко распространены. Общее число уже синтезированных комплексных соединений, по-видимому, превышает число соединений, обычно относимых к простым. К существуют в растворах, расплавах, в и газообразном состоянии. Переход вещества из одного физ. состояния в другое может приводить к изменению состава и строения К, к распаду одних комплексных группировок и образованию новых.
Ядро К (комплекс) составляет центральный — комплексообразователь (в приведенном примере ) и координированные, т. е. связанные с ним, молекулы или ионы, называемые лигандами (в данном случае кислотный остаток ). Лиганды составляют внутреннюю сферу комплекса. Бывают К, состоящие только из центрального и лигандов, например карбонилы металлов ()7, ()6, ()5 и др. Если в состав комплекса входят ионы, не связанные непосредственно с центральным то их выделяют во внешнюю сферу комплекса. Внешнесферными могут быть и катионы, например К+ в 4( ()6), и анионы, например 42- в (Сu (MH3)4) 4. При записи формулы К внешнесферные ионы выносятся за квадратные скобки. Комплексная группировка, несущая избыточный положительный электрический заряд, как в ( (3)4)2+, или отрицательный, как в ( ()6)4-, называется комплексным ионом. В растворах К с внешнесферными ионами практически нацело диссоциированы по схеме, например:
2(4) = 2++(4)2-
( (3)4) 4 = ( (3)4)2++42-.
Комплексные ионы тоже могут диссоциировать в растворе. Например:
(4)2- Û 2++4-.
Устойчивость К в растворе определяется константой диссоциации К его комплексного иона:
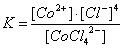 . .
(При записи константы диссоциации в квадратные скобки берут равновесные концентрации ионов). Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки — неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, ( (2)6)3+ и (Сr (2)6)3+ имеют почти одинаковые энергии связи Me — 2 (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) — медленно.
Число ионов или молекул, непосредственно связанных с центральным называется его координационным числом (К. ч.). Например, в К 4( ()6), ()7 и (Сu (3)4) 4 К. ч. центральных равны, соответственно, 6, 7 и 4. К. ч. у различных комплексообразователей различны. Их значения меняются в зависимости от размеров и природы центральных и лигандов. В настоящее время известны К. ч. от 1 до 12, однако чаще всего приходится иметь дело с К. ч.4 и 6.
Составные части К чрезвычайно разнообразны. В качестве центральных чаще всего выступают переходных элементов (, , , , , Со, , Си, , , , , , , , , , , , , , , , lr, , , , редкоземельные элементы, элементы группы актиноидов), а также некоторые неметаллы, например В, Р, . Лигандами могут быть анионы кислот (-, -, -, -, -, -2, 42-, 43- и др.) и самые разнообразные нейтральные органические и неорганические молекулы и радикалы, содержащие О, , Р, , , С.
К с анионами кислот во внутренней сфере (ацидокомплексы) — наиболее типичные представители неорганических комплексов. Самым распространенным лигандом является вода. При растворении простых солей в воде образуются аквокомплексы, например, по схеме 2 + 62=( (2)6)2++ 2. аквокомплексы называются
При растворении солей в различных органических и неорганических жидкостях образуются разнообразные сольватокомплексы. сольватокомплексы называют К ним относятся продукты присоединения аммиака — аммиакаты, например ( (3)6) 2, продукты присоединения спирта — алкоголяты, эфира — эфираты и т. д. Сложные молекулы присоединяются к центральному через (вода, спирты, эфиры и т. п.), (аммиак, его органические производные — амины), (3, производные фосфина), и др. Часто лиганд присоединяется к центральному несколькими из своих Такие лиганды называют полидентатными. Среди сложных органических производных встречаются лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью (соответственно би-, три-, тетра-, пента-, гекса- и октадентатные лиганды). Полидентатные органические лиганды могут образовать циклические комплексы типа неэлектролитов (см. Внутрикомплексные соединения), например:
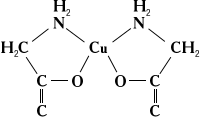
Самыми лучшими лигандами в смысле устойчивости образуемых ими К являются комплексоны — аминополикарбоновые кислоты, среди которых наибольшее распространение получила этилендиаминтетрауксусная кислота
(2)222 (2)2 (комплексон , ЭДТА).
Неорганические ацидолиганды обычно моно-, реже бидентатны. Например, в соединении (4)2( (3)6) каждая 3-группа присоединяется к двумя и является бидентатной. К. ч. Се в этом соединении равно 12.
Между К и обычными (простыми) соединениями нет определенной границы. Одни и те же вещества, в зависимости от поставленных задач исследования, часто можно рассматривать и как простые и как комплексные. Например, в любом неорганическом веществе обычно относимые к комплексообразователям, обладают определенным К. ч. и, следовательно, ближайшей сферой, принципиально не отличимой от аналогичной группировки в обычном К
Теория строения К берет свое начало от представлений А. Вернера (1893), который ввел важные для целого исторического периода понятия "главной" и "побочной" валентности, а также представления о координации, координационном числе, геометрии комплексной молекулы. Значительный вклад в исследование химии К, и, в частности, в установление связи между строением К и реакционной способностью координированных групп, внесли советские ученые Л. А. Чугаев, И. И. Черняев и др.
Однако классическая координационная теория оказалась бессильной объяснить причины образования К некоторых новых классов, предсказать их строение, а также установить взаимосвязь между строением и физическими свойствами К
Удовлетворительное разрешение этих вопросов стало возможным лишь на базе современных квантово-механических представлений о природе связи. Подробнее см. Валентность, Квантовая химия, Молекулярных орбиталей метод, Химическая связь.
К находят широкое применение для выделения и очистки металлов, меди, в процессах разделения редкоземельных элементов, щелочных металлов и в ряде других технологических процессов. К широко используют в анализе для качественного обнаружения и количественного определения самых разнообразных элементов. В живых организмах различные типы К представлены соединениями ионов металлов (, , , , , , Со) с (т. н. металлопротеиды), а также витаминами, коферментами, транспортными и др. веществами, выполняющими специфические функции в обмене веществ. Особенно велика роль природных К в процессах дыхания, фотосинтеза, окисления биологического, в ферментативном катализе.
Лит.: Современная координационных соединений, под ред. Дж. Льюиса и Р. Уилкинса, пер. с англ., М., 1963; Берсукер И. Б., Аблов А. В., связь в комплексных соединениях, Кишинев, 1962; Гринберг А. А., Введение в химию комплексных соединений, 2 изд., Л. — М., 1951; Дей К., Селбин Д., Теоретическая неорганическая пер. с англ., М., 1971; Головня В. А., Федоров И. А., Основные понятия химии комплексных соединений, М., 1961; Яцимирский К. Б., Термохимия комплексных соединений, М., 1951; Коттон Ф., Уилкинсон Дж., Современная неорганическая пер. с англ., ч. 1—3, М., 1969.
Б. Ф. Джуринский. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |
|