
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Клапейрона уравнение | Клапейрона уравнение (далее К) Клапейрона — уравнение, найденная Б. П. Э. Клапейроном (1834) зависимость между физическими величинами, определяющими состояние идеального газа: давлением газа р, его объемом и абсолютной температурой Т.
К записывается в виде pV = ВТ, где коэффициент пропорциональности В зависит от массы газа. Д. И. Менделеев, используя Авогадро закон, вывел в 1874 уравнение состояния для 1 моля идеального газа pV = RT, где R — универсальная газовая постоянная. Для газа, имеющего общую массу М и молекулярную массу m,
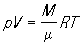 , или pV=NkT," , или pV=NkT,"
где — число частиц газа, k — Больцмана постоянная. К представляет собой уравнение состояния, идеального газа, которое объединяет Бойля — Мариотта закон (зависимость между р и при Т = const), Гей-Люссака закон (зависимость от Т при р = const) и Авогадро закон (согласно этому закону, газы при одинаковых значениях р, и Т содержат одинаковое число молекул ).
К — наиболее простое уравнение состояния, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах (например, атмосферный воздух, продукты сгорания в газовых двигателях и др.), когда они близки по своим свойствам к идеальному газу. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 13:20:13
|

|

|
 |
|

|
 |
 |
 |
|