
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Железо | (далее Ж)(латинское Ferrum), , элемент группы периодической системы номер 26, масса 55,847; блестящий металл. Элемент в природе состоит из четырех стабильных изотопов: 54 (5,84%), 56 (91,68%), 57 (2,17%) и 58 (0,31%).
Историческая справка. Ж было известно еще в доисторические времена, однако широкое применение нашло значительно позже, т. к. в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определенном уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Ж о чем свидетельствуют его названия на языках древних народов: древнеегипетское "бени-пет" означает "небесное древнегреческое sideros связывают с латинским sidus (родительный падеж sideris) - звезда, небесное тело. В хеттских текстах 14 в. до н. э. упоминается о Ж как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, французское fer, итальянское ferro).
Способ получения Ж из руд был изобретен в западной части Азии во 2-м тысячелетии до н. э.; вслед за тем применение Ж распространилось в Вавилоне, Египте, Греции; на смену бронзовому веку пришел железный век. Гомер (в 23-й песне "Илиады") рассказывает, что Ахилл наградил диском из крицы победителя в соревновании по метанию диска. В Европе и Древней Руси в течение многих веков Ж получали по сыродутному процессу. руду восстанавливали древесным углем в горне (см. Восстановление металлов), устроенном в яме; в горн мехами нагнетали воздух, продукт восстановления - крицу ударами молота отделяли от шлака и из нее выковывали различные изделия. По мере усовершенствования способов дутья и увеличения высоты горна температура процесса повышалась и часть Ж науглероживалась, т. е. получался чугун; этот сравнительно хрупкий продукт считали отходом производства. Отсюда название чугуна "чушка", "свинское - английское pig iron. Позже было замечено, что при загрузке в горн не руды, а чугуна также получается низкоуглеродистая крица, причем такой двухстадийный процесс (см. Кричный передел) оказался более выгодным, чем сыродутный. В 12-13 вв. кричный способ был уже широко распространен. В 14 в. чугун начали выплавлять не только как полупродукт для дальнейшего передела, но и как материал для отливки различных изделий. К тому же времени относится и реконструкция горна в шахтную печь ("домницу"), а затем и в доменную печь. В середине 18 в. в Европе начал применяться тигельный процесс получения стали, который был известен на территории Сирии еще в ранний период средневековья, но в дальнейшем оказался забытым. При этом способе сталь получали расплавлением металлические шихты в небольших сосудах (тиглях) из высокоогнеупорной массы. В последней четверти 18 в. стал развиваться пудлинговый процесс передела чугуна в Ж на поду пламенной отражательной печи (см. Пудлингование). Промышленный переворот 18 - начала 19 вв., изобретение паровой машины, строительство дорог, крупных мостов и парового флота вызвали громадную потребность в Ж и его сплавах. Однако все существовавшие способы производства Ж не могли удовлетворить потребности рынка. Массовое производство стали началось лишь в середине 19 в., когда были разработаны бессемеровский, томасовский и мартеновский процессы. В 20 в. возник и получил широкое распространение электросталеплавильный процесс, дающий сталь высокого качества.
Распространенность в природе. По содержанию в литосфере (4,65% по массе) Ж занимает второе место среди металлов (на первом Оно энергично мигрирует в земной коре, образуя около 300 минералов (окислы, сульфиды, силикаты, карбонаты, фосфаты и т. д.). Ж принимает активное участие в магматических, гидротермальных и гипергенных процессах, с которыми связано образование различных типов его месторождений (см. Железные руды). Ж - металл земных глубин, оно накапливается на ранних этапах магмы, в ультраосновных (9,85%) и основных (8,56%) породах (в гранитах его всего 2,7%). В биосфере Ж накапливается во многих морских и континентальных осадках, образуя осадочные руды.
Важную роль в геохимии Ж играют окислительно-восстановительные реакции - переход 2-валентного Ж в 3-валентное и обратно. В биосфере при наличии органических веществ 3+ восстанавливается до 2+ и легко мигрирует, а при встрече с воздуха 2+ окисляется, образуя скопления гидроокисей 3-валентного Ж Широко распространенные соединения 3-валентного Ж имеют красный, желтый, бурый цвета. Этим определяется окраска многих осадочных горных пород и их наименование - "красно-цветная формация" (красные и бурые суглинки и глины, желтые пески и т. д.).
Физические и свойства. Значение Ж в современной технике определяется не только его широким распространением в природе, но и сочетанием весьма ценных свойств. Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддается прокатке, штамповке и волочению. Способность растворять и др. элементы служит основой для получения разнообразных сплавов.
Ж может существовать в виде двух решеток: a- и g- объемноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910 °С устойчиво a - с ОЦК-решеткой (а = 2,86645 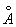 при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решеткой (а = 3,64 при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решеткой (а = 3,64 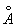 ). Выше 1400°С вновь образуется ОЦК-решетка d- (а = 2,94 ). Выше 1400°С вновь образуется ОЦК-решетка d- (а = 2,94 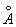 ), устойчивая до температуры плавления (1539°С). a - ферромагнитно вплоть до 769°С (точка Модификация g- и d- парамагнитны. ), устойчивая до температуры плавления (1539°С). a - ферромагнитно вплоть до 769°С (точка Модификация g- и d- парамагнитны.
Полиморфные превращения Ж и стали при нагревании и охлаждении открыл в 1868 Д. К. Чернов. образует с Ж твердые растворы внедрения, в которых С, имеющие небольшой радиус (0,77 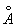 ), размещаются в междоузлиях решетки металла, состоящей из более крупных ( радиус 1,26 ), размещаются в междоузлиях решетки металла, состоящей из более крупных ( радиус 1,26  ). Твердый раствор в g- наз. аустенитом, а в (a-- ферритом. Насыщенный твердый раствор в g- содержит 2,0% С по массе при 1130°С; a- растворяет всего 0,02- 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит - пересыщенный твердый раствор в a- , очень твердый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твердости и пластичности (см. Железо - углеродистые сплавы. Термическая обработка металлов). ). Твердый раствор в g- наз. аустенитом, а в (a-- ферритом. Насыщенный твердый раствор в g- содержит 2,0% С по массе при 1130°С; a- растворяет всего 0,02- 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит - пересыщенный твердый раствор в a- , очень твердый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твердости и пластичности (см. Железо - углеродистые сплавы. Термическая обработка металлов).
Физические свойства Ж зависят от его чистоты. В промышленных материалах Ж как правило, сопутствуют примеси серы, Даже при очень малых концентрациях эти примеси сильно изменяют свойства металла. Так, сера вызывает т. н. красноломкость, (даже 10-20% Р) - хладноломкость; и уменьшают пластичность, а увеличивает хрупкость Ж (т. н. хрупкость). Снижение содержания примесей до 10-7-10-9% приводит к существенным изменениям свойств металла, в частности к повышению пластичности.
Ниже приводятся физические свойства Ж относящиеся в основном к металлу с общим содержанием примесей менее 0,01% по массе:
радиус 1,26 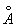
Ионные радиусы 2+,80 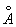 , 3+,67 , 3+,67 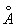
Плотность (20o) 7,874 г/см3
tпл 1539°С
tkип около 3200оС
Температурный коэффициент линейного расширения (20°С) 11,7·10-6
Теплопроводность (25°С) 74,04 вт/(м·К)
(0,177 (кал/см·сек·град))
Теплоемкость Ж зависит от его структуры и сложным образом изменяется с температурой; средняя удельная теплоемкость (0-1000o) 640,57 дж/(кг·К) (0,153 кал/ (г·град)).
Удельное электрическое сопротивление (20°С)
9,7·10-8ом·м (9,7·10-6ом·см)
Температурный коэффициент электрического сопротивления
(0-100°С) 6,51·10-3
Модуль Юнга 190-210·103 Мн/м.2
(19-21·103кгс/мм2)
Температурный коэффициент модуля Юнга
4·10-6
Модуль сдвига 84,0·103 Мн/м2 (8,4·103кгс/мм2)
Кратковременная прочность на разрыв
170-210Мн/м2(17-21кгс/мм2)
Относительное удлинение 45-55%
Твердость по Бринеллю 350-450 Мн/м2
(35-45 кгс/мм2)
Предел текучести 100Мн/м2 (10 кгс/мм2)
Ударная вязкость 300 Мн/м2 (30 кгс/мм2)
Конфигурация внешней электронной оболочки 3d64s2. Ж проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Ж С Ж образует закись , окись 23 и закись-окись 34 (соединение с 23, имеющее структуру шпинели). Во влажном воздухе при обычной температуре Ж покрывается рыхлой ржавчиной (23·n2). Вследствие своей пористости ржавчина не препятствует доступу и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. В результате различных видов коррозии ежегодно теряются миллионы тонн Ж (см. Коррозия металлов). При нагревании Ж в сухом воздухе выше 200°С оно покрывается тончайшей окисной пленкой, которая защищает металл от коррозии при обычных температурах; это лежит в основе технического метода защиты Ж - воронения. При нагревании в водяном паре Ж окисляется с образованием 34 (ниже 570°С) или (выше 570°С) и выделением
Гидроокись ()2 образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей 2+ в атмосфере или При соприкосновении с воздухом ()2 сперва зеленеет, затем чернеет и наконец быстро переходит в красно-бурую гидроокись ()3. Закись проявляет основные свойства. Окись 23 амфотерна и обладает слабо выраженной кислотной функцией; реагируя с более основными окислами (например, с ), она образует ферриты - соединения типа 23·nMeO, имеющие ферромагнитные свойства и широко применяющиеся в радиоэлектронике. Кислотные свойства выражены и у 6-валентного Ж существующего в виде ферратов, например 24, солей не выделенной в свободном состоянии кислоты.
Ж легко реагирует с галогенами и галогеноводородами, давая соли, например 2 и 3. При нагревании Ж с серой образуются сульфиды и 2. Карбиды Ж - 3 (цементит) и 2 (e-карбид) - выпадают из твердых растворов в Ж при охлаждении. 3 выделяется также из растворов в жидком Ж при высоких концентрациях С. подобно дает с Ж твердые растворы внедрения; из них выделяются нитриды 4 и 2. С Ж дает лишь малоустойчивые гидриды, состав которых точно не установлен. При нагревании Ж энергично реагирует с и образуя силициды (например, 3) и фосфиды (например, 3).
Соединения Ж с многими элементами (О, Ж |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 12:08:37
|

|

|
 |
|

|
 |
 |
 |
|