
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Гелий | (далее Г)(лат. Helium), символ Не, элемент группы периодической системы, относится к инертным газам; порядковый номер 2, масса 4,0026; газ без цвета и запаха. Природный Г состоит из 2 стабильных изотопов: 3 и 4 (содержание 4 резко преобладает).
Впервые Г был открыт не на Земле, где его мало, а в атмосфере Солнца. В 1868 француз Ж. Жансен и англичанин Дж. Н. Локьер исследовали спектроскопически состав солнечных протуберанцев. Полученные ими снимки содержали яркую желтую линию (т. н. D3-линию), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 Локьер объяснил ее происхождение присутствием на Солнце нового элемента, который и назвали (от греч. helios — Солнце). На Земле Г впервые был выделен в 1895 англичанином У. Рамзаем из радиоактивного минерала клевеита. В спектре газа, выделенного при нагревании клевеита, оказалась та же линия.
в природе. На Земле Г мало: 1 м3 воздуха содержит всего 5,24 см3 Г а каждый килограмм земного материала — 0,003 мг Г По распространенности же во Вселенной Г занимает 2-е место после на долю Г приходится около 23% космической массы.
На Земле Г (точнее, изотоп 4) постоянно образуется при распаде тория и других радиоактивных элементов (всего в земной коре содержится около 29 радиоактивных изотопов, продуцирующих 4).
Примерно половина всего Г сосредоточена в земной коре, главным образом в ее гранитной оболочке, аккумулировавшей основные запасы радиоактивных элементов. Содержание Г в земной коре невелико — 3 · 10-7% по массе. Г накапливается в свободных газовых скоплениях недр и в нефтях; такие месторождения достигают промышленных масштабов. Максимальные концентрации Г (10—13%) выявлены в свободных газовых скоплениях и газах рудников и (20—25%) в газах, спонтанно выделяющихся из подземных вод. Чем древнее возраст газоносных осадочных пород и чем выше в них содержание радиоактивных элементов, тем больше Г в составе природных газов. Вулканическим газам свойственно обычно низкое содержание Г
Добыча Г в промышленных масштабах производится из природных и нефтяных газов как углеводородного, так и состава. По качеству сырья месторождения подразделяются: на богатые (содержание Не > 0,5% по объему); рядовые (0,10—0,50) и бедные < 0,10). В СССР природный Г содержится во многих нефтегазовых месторождениях. Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (шт. Канзас, Техас, Нью-Мексико, Юта).
В природном Г любого происхождения (атмосферном, из природных газов, из радиоактивных минералов, метеоритном и т.д.) преобладает изотоп 4. Содержание 3 обычно мало (в зависимости от источника Г оно колеблется от 1,3 · 10-4 до 2 · 10-8%) и только в Г выделенном из метеоритов, достигает 17—31,5%. Скорость образования 4 при радиоактивном распаде невелика: в 1 т гранита, содержащего, например, 3 г и 15 г тория, образуется 1 мг Г за 7,9 млн. лет; однако, поскольку этот процесс протекает постоянно, за время существования Земли он должен был бы обеспечить содержание Г в атмосфере, литосфере и гидросфере, значительно превышающее наличное (оно составляет около 5 · 1014 м3). Такой дефицит Г объясняется постоянным улетучиванием его из атмосферы. Легкие Г попадая в верхние слои атмосферы, постепенно приобретают там скорость выше 2-й космической и тем самым получают возможность преодолеть силы земного притяжения. Одновременное образование и улетучивание Г приводят к тому, что концентрация его в атмосфере практически постоянна.
Изотоп 3, в частности, образуется в атмосфере при бета-распаде тяжелого изотопа водорода — трития (Т), возникающего, в свою очередь, при взаимодействии нейтронов космического излучения с воздуха:
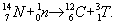
Ядра 4 (состоящие из 2 протонов и 2 нейтронов), называют альфа-частицами или — самые устойчивые среди составных ядер. Энергия связи нуклонов (протонов и нейтронов) в 4 имеет максимальное по сравнению с ядрами других элементов значение (28,2937 Мэв); поэтому образование ядер 4 из ядер (протонов) 1Н сопровождается выделением огромного количества энергии. Считают, что эта ядерная реакция: 41 = 4 +2b+ + 2n (одновременно с 4 образуются 2 позитрона (b +) и 2 нейтрино (n)) служит основным источником энергии Солнца и других схожих с ним звезд. Благодаря этому процессу и накапливаются весьма значительные запасы Г во Вселенной.
Физические и свойства. При нормальных условиях Г — одноатомный газ без цвета и запаха. Плотность 0,17846 г/л, tkип — 268,93°С. Г — единственный элемент, который в жидком состоянии не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. Наименьшее давление перехода жидкого Г в твердый 2,5 Мн/м2 (25 am), tпл при этом равна — 272,1°С. Теплопроводность (при 0°С) 143,8 · 10-3 вт/см ( (343,4 · 10-6 кал/(см (град (сек)). Радиус Г определенный различными методами, составляет от 0,85 до 1,33 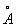 . В 1 л воды при 20°С растворяется около 8,8 мл Г Энергия первичной ионизации Г больше, чем у любого другого элемента, — 39,38 · 10-13дж (24,58 эв); сродством к электрону Г не обладает. Жидкий Г состоящий только из 4, проявляет ряд уникальных свойств (см. ниже). . В 1 л воды при 20°С растворяется около 8,8 мл Г Энергия первичной ионизации Г больше, чем у любого другого элемента, — 39,38 · 10-13дж (24,58 эв); сродством к электрону Г не обладает. Жидкий Г состоящий только из 4, проявляет ряд уникальных свойств (см. ниже).
До настоящего времени попытки получить устойчивые соединения Г оканчивались неудачами (см. Инертные газы). Спектроскопически доказано существование в разряде иона 2+. В 1967 советские исследователи В. П. Бочин, Н. В. Закурин, В. К. Капышев сообщили о синтезе в зоне дугового разряда за счет реакции Г с с 3 или с 5 ионов +, 22+ и 2+. Согласно расчету, величина энергии диссоциации иона + равна 2,2 эв.
Получение и применение. В промышленности Г получают из природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1% Г От других газов Г отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Благодаря инертности Г широко применяют для создания защитной атмосферы при плавке, резке и сварке активных металлов. Г менее электропроводен, чем другой инертный газ — и поэтому электрическая дуга в атмосфере Г дает более высокие температуры, что значительно повышает скорость дуговой сварки. Благодаря небольшой плотности в сочетании с негорючестью Г применяют для наполнения стратостатов. Высокая теплопроводность Г его инертность и крайне малая способность вступать в ядерную реакцию с нейтронами позволяют использовать Г для охлаждения реакторов. Жидкий Г — самая холодная жидкость на Земле, служит хладагентом при проведении различных научных исследований. На определении содержания Г в радиоактивных минералах основан один из методов определения их абсолютного возраста (см. Геохронология). Благодаря тому что Г очень плохо растворим в крови, его используют как составную часть искусственного воздуха, подаваемого для дыхания водолазам (замена на Г предотвращает появление кессонной болезни). Изучаются возможности применения Г и в атмосфере кабины космического корабля.
С. С. Бердоносов, В. П. Якуцени.
жидкий. Относительно слабое взаимодействие Г приводит к тому, что он остается газообразным до более низких температур, чем любой другой газ. Максимальная температура, ниже которой он может быть сжижен (его критическая температура T), равна 5,20 К. Жидкий Г — единственная незамерзающая жидкость: при нормальном давлении (Грис. 1 |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 29.10.2024 17:01:19
|

|

|
 |
|

|
 |
 |
 |
|