
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Газы (агрегатное состояние вещества) | Газы (далее Г) (французское gaz; название предложено голланским ученым Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объем. Вещество в газообразном состоянии широко распространено в природе. Г (агрегатное состояние вещества) образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Солнце, звезды, облака межзвездного вещества состоят из Г (агрегатное состояние вещества) — нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях Г (агрегатное состояние вещества) представляют собой, как правило, смеси индивидуальных Г (агрегатное состояние вещества)
Г (агрегатное состояние вещества) обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твердых тел и жидкостей, объем Г (агрегатное состояние вещества) существенно зависит от давления и температуры. Коэффициент объемного расширения Г (агрегатное состояние вещества) в обычных условиях (0—100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1. В табл. приведены данные о физических свойствах наиболее распространенных Г (агрегатное состояние вещества)
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление р — температура Т (в р, Т-диаграмме, рис. 1). При температурах ниже критической Тк (см. Критическое состояние) эта область ограничена кривыми сублимации (возгонки) / и парообразования . Это означает, что при любом давлении ниже критического рк существует температура Т (см. рис. 1), определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. В состояниях на кривой 1 (ниже тройной точки Tp) газ находится в равновесии с твердым веществом (твердой фазой), а на кривой (между тройной и критической точкой К.) — с жидкой фазой. Газ в этих состояниях обычно называют паром вещества.
При температурах ниже Тк можно сконденсировать Г (агрегатное состояние вещества) — перевести его в др. агрегатное состояние (твердое или жидкое). При этом фазовое превращение Г (агрегатное состояние вещества) в жидкость или твердое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности, энтальпии, теплоемкости и др.). Процессы конденсации Г (агрегатное состояние вещества), особенно сжижение газов, имеют важное техническое значение.
При Т > Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между Г (агрегатное состояние вещества) и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору вещества (кривую постоянной плотности или удельного объема, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
В связи с тем что область газового состояния очень обширна, свойства Г (агрегатное состояние вещества) при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0° С и атмосферном давлении) плотность Г (агрегатное состояние вещества) примерно в 1000 раз меньше плотности того же вещества в твердом или жидком состоянии. При комнатной температуре, но давлении, в 1017 раз меньшем атмосферного (предел, достигнутый современной вакуумной техникой), плотность Г (агрегатное состояние вещества) составляет около 10 -20 г/см3. В космических условиях плотность Г (агрегатное состояние вещества) может быть еще на 10 порядков меньше (~10-30/см3).
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать Г (агрегатное состояние вещества), обладает огромной плотностью (например, в центре некоторых звезд ~109 г/см3). В зависимости от условий в широких пределах изменяются и др. свойства Г (агрегатное состояние вещества) — теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория Г (агрегатное состояние вещества) Молекулярно-кинетическая теория рассматривает Г (агрегатное состояние вещества) как совокупность слабо взаимодействующих частиц (молекул или ), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удается объяснить основные физические свойства Г (агрегатное состояние вещества), особенно полно — свойства разреженных Г (агрегатное состояние вещества)
У достаточно разреженных Г (агрегатное состояние вещества) средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 Г (агрегатное состояние вещества) находится~ 1019 молекул и среднее расстояние между ними составляет ~ 10-6 см, или ~ 100 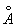 , тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5—10 , тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5—10 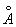 . Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объем, в котором эти силы могут сказываться (как бы "собственный объем" всех молекул), составляет 10-3—10-4 от полного объема Г (агрегатное состояние вещества) Это позволяет считать собственный объем молекул Г (агрегатное состояние вещества) в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Г (агрегатное состояние вещества) все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведен график этого распределения для при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул . Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10—20 раз меньше среднего расстояния между молекулами, так что общий объем, в котором эти силы могут сказываться (как бы "собственный объем" всех молекул), составляет 10-3—10-4 от полного объема Г (агрегатное состояние вещества) Это позволяет считать собственный объем молекул Г (агрегатное состояние вещества) в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Г (агрегатное состояние вещества) все направления движения его молекул равновероятны, а скорости распределены в соответствии с Максвелла распределением. На рис. 2 приведен график этого распределения для при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул 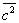 связанная с температурой Т газа соотношением связанная с температурой Т газа соотношением
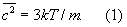
Здесь k — Больцмана постоянная, m — масса молекулы. Уравнение (1) позволяет установить связь между средней кинетической энергией одной молекулы и температурой газа:
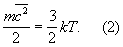
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры — температура есть мера кинетической энергии молекул.
Поскольку молекулы идеального Г (агрегатное состояние вещества) обладают лишь кинетической энергией, внутренняя энергия такого Г (агрегатное состояние вещества) не зависит от занимаемого им объема (закон Джоуля).
Молекулярно-кинетическая теория рассматривает давление Г (агрегатное состояние вещества) на стенки сосуда, в котором он находится, как воздействие ударов молекул, усредненное по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
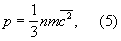
где n — число молекул в единице объема. Уравнения (2) и (3) позволяют записать уравнение состояния идеального Г (агрегатное состояние вещества) в виде
p = nkT. (4)
уравнение (4), записанное для 1 моля Г (агрегатное состояние вещества), содержащего = 6,023- 1023 молекул (см. Авогадро число), называют Клапейрона уравнением:
pv = RT. (5)
Здесь R = kN — универсальная газовая постоянная, v — объем, приходящийся на 1 моль. уравнение Клапейрона обобщает эмпирические газовые законы Бойля — Мариотта и Гей-Люссака (см. Бойля — Мариотта закон, Гей-Люссака законы). Из уравнения (5) следует также, что при одинаковых температуре и давлении идеальные Г (агрегатное состояние вещества), взятые в количестве 1 моля, имеют равные объемы и в любом таком Г (агрегатное состояние вещества) в единице объема содержится равное количество молекул (см. Авогадро закон).
В условиях теплового равновесия температура и давление Г (агрегатное состояние вещества) по всему его объему одинаковы, молекулы движутся хаотично, в Г (агрегатное состояние вещества) нет упорядоченных потоков. Возникновение в Г (агрегатное состояние вещества) перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин.
Кинетические свойства Г (агрегатное состояние вещества) — теплопроводность, диффузию, вязкость — молекулярно-кинетическая теория рассматривает с единой точки зрения: диффузию как перенос молекулами массы, теплопроводность как перенос ими энергии, вязкость как перенос количества движения. Модель идеального Г (агрегатное состояние вещества) для анализа явлений переноса непригодна, ибо в этих процессах существенную роль играют столкновения молекул (при которых происходит передача какой-нибудь из переносимых величин, например энергии) и "размер" молекул (влияющий на частоту столкновений). Поэтому в простейшем случае явления переноса в Г (агрегатное состояние вещества) рассматриваются для разреженного Г (агрегатное состояние вещества), молекулы которого в первом приближении считаются упругими шариками с определенным диаметром s, причем эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с ее средней длиной свободного пробега 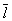 : :
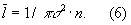
Размер 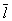 существенно влияет на процессы переноса в разреженном Г (агрегатное состояние вещества) В частности, если характерный размер объема, занимаемого Г (агрегатное состояние вещества), больше существенно влияет на процессы переноса в разреженном Г (агрегатное состояние вещества) В частности, если характерный размер объема, занимаемого Г (агрегатное состояние вещества), больше 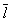 , то теплопроводность и вязкость Г (агрегатное состояние вещества) не зависят от давления. Наоборот, когда , то теплопроводность и вязкость Г (агрегатное состояние вещества) не зависят от давления. Наоборот, когда 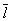 больше характерного размера, теплопроводность и вязкость Г (агрегатное состояние вещества) с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды). больше характерного размера, теплопроводность и вязкость Г (агрегатное состояние вещества) с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см. Дьюара сосуды).
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см. Межмолекулярное взаимодействие). Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчета коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведенной температуры T* = kT/e. Эта температура характеризует отношение кинетической энергии молекул (~kT) к их потенциальной энергии (e — глубина потенциальной ямы при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г (агрегатное состояние вещества), могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г. При повышении плотности изменяются свойства Г (агрегатное состояние вещества), они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г (агрегатное состояние вещества) становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г (агрегатное состояние вещества) пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г (агрегатное состояние вещества) от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г (агрегатное состояние вещества)), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г (агрегатное состояние вещества) (см. Ван-дер-Ваальса уравнение).
К наиболее теоретически обоснованным, во всяком случае для состояний, удаленных от критической точки, относится вириальное уравнение состояния:
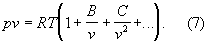
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
В Г (агрегатное состояние вещества) малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г (агрегатное состояние вещества) в разложении (7) можно пренебречь всеми членами после члена с коэффициента В. В соответствии с температурным изменением В, при т. н. температуре Бойля ТВ (см. Бойля точка) В обращается в нуль, и умеренно плотный Г (агрегатное состояние вещества) ведет себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г (агрегатное состояние вещества) Внутренняя энергия реального Г (агрегатное состояние вещества) оказывается зависящей от его объема (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
С межмолекулярным взаимодействие связано также изменение температуры реального Г (агрегатное состояние вещества) при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется дросселированием). Мерой изменения температуры Г при дросселировании служит Джоуля — Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г (агрегатное состояние вещества)), отрицательным (нагрев Г (агрегатное состояние вещества)) либо равным нулю при т. н. температуре инверсии (см. Джоуля — Томсона явление). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Внутреннее строение молекул Г (агрегатное состояние вещества) слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Г (агрегатное состояние вещества) Напротив, калорические свойства Г (агрегатное состояние вещества) (теплоемкость, энтропия и др.), а также его электрические и свойства существенно зависят от внутреннего строения молекул. Например, для расчета (в первом приближении) теплоемкости Г (агрегатное состояние вещества) при постоянном объеме cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) iвн. В соответствии с равнораспределения законом классической статистической физики на каждую степень свободы молекулы Г (агрегатное состояние вещества) (поступательную, колебательную, вращательную) приходится энергия, равная 1/2 · kT. Отсюда теплоемкость 1 моля
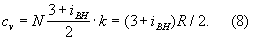
Для точного расчета калорических свойств Г (агрегатное состояние вещества) необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г (агрегатное состояние вещества) Для большого числа веществ в состоянии идеального Г (агрегатное состояние вещества) калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
Электрические свойства Г (агрегатное состояние вещества) связаны в первую очередь с возможностью ионизации молекул или т. е. с появлением в Г (агрегатное состояние вещества) электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Г (агрегатное состояние вещества) являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г (агрегатное состояние вещества) увеличивается. Зависимость электропроводности Г (агрегатное состояние вещества) от различных физических факторов рассмотрена в ст. Электрический разряд в газах.
При температурах начиная с нескольких тыс. градусов всякий Г (агрегатное состояние вещества) частично ионизуется и превращается в плазму. Если концентрация зарядов в плазме невелика, то свойства ее мало отличаются от свойств обычного Г (агрегатное состояние вещества)
По свойствам Г (агрегатное состояние вещества) делятся на диамагнитные (к ним относятся, например, инертные газы, 2, 2, 2, 2) и парамагнитные (например, 2). Диамагнитны те Г (агрегатное состояние вещества), молекулы которых не имеют постоянного момента и приобретают его лишь под влиянием внешнего поля (см. Диамагнетизм). Те же Г (агрегатное состояние вещества), у которых молекулы обладают постоянным моментом, во внешнем поле ведут себя как парамагнетики (см. Парамагнетизм). Учет межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г (агрегатное состояние вещества), например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см. Газовая динамика, Аэродинамика разреженных газов).
В современной физике Г (агрегатное состояние вещества) называют не только одно из агрегатных состояний вещества. К Г (агрегатное состояние вещества) с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный Г (агрегатное состояние вещества)), фононов в жидком (фононный Г (агрегатное состояние вещества)) и т. д. Г (агрегатное состояние вещества) элементарных частиц и квазичастиц обладающих целым спином, т. н. бозонов (например, фотонов, p-мезонов, фононов), называется бозе-газом. Его свойства рассматривает квантовая статистика Бозе — Эйнштейна. Свойства частиц Г (агрегатное состояние вещества) с полуцелым спином — фермионов (например, электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика — Дирака (см. Статистическая физика).
Физические свойства газов<
Свойства газов
|
2
|
|
2
| Воздух |
2
|
Углекислый газ 2
|
Масса 1 моля (г)
|
28,02
|
39,94
|
2,016
|
28,96
|
32,00
|
44,00
|
Плотность при 0° и 1 ат* (кг/м3)
|
1,2506
|
1,7839
|
0,0899
|
1,2928
|
1,4290
|
1,976
|
Теплоемкость при постоянном объеме сv и 0° (кдж/моль•град)
|
20,85
|
12,48
|
20,35
|
20,81
|
20,89
|
30,62 (55°)
|
Скорость звука при 0° (м/сек)
|
333,6
|
319
|
1286
|
331,5
|
314,8
|
260,3
|
Вязкость h при 0° (h•106 н•сек /м2)
|
16,6
|
21,2
|
8,4
|
17,1
|
19,2
|
13,8
|
Теплопроводность l при 0° (l•102 дж/м•сек•град)
|
2,43
|
1,62
|
16,84
|
2,41
|
2,44
|
1,45
|
Диэлектрическая проницаемость e при 0° и 1 ат*
|
1,000588
|
1,000536
|
1,000272
|
1,000590
|
1,000531
|
1,000988
|
Удельная восприимчивость c при 20° (c•106 на 1 г)
|
-0,43
|
-0,49
|
-1,99
|
—
|
+107,8
|
0,48
|
Лит.: Кириллин В. А., Сычев В. В. и Шейндлин А. Е., Техническая термодинамика, М., 1969; Кикоин И. К. и Кикоин А. К., Молекулярная физика, М., 1963; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Термодинамические свойства индивидуальных веществ. Справочник, под ред. В. П. Глушко, 2 изд., т. 1—2, М., 1962.
Э. Э. Шпильрейн.

Рис. 2. Распределение Максвела для молекул азота при температурах 20 и 500°С. По оси ординат отложена доля молекул (в %), обладающих скоростями между с и (с + 10) м/сек; сн — наиболее вероятная скорость, которой обладает наибольшее число молекул при данной температуре; — средняя арифметическая скорость молекул; — средняя квадратичная скорость.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 21.11.2024 11:44:02
|

|

|
 |
|

|
 |
 |
 |
|