
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Циклические нуклеотиды | Циклические нуклеотиды (далее Ц)нуклеотиды, в молекулах которых остаток кислоты, связываясь с рибозы в 5" и 3" положениях, образует кольцо; универсальные регуляторы биохимических процессов в живых клетках.
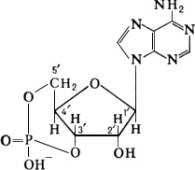
Циклический 3",5"-аденозинмонофосфат (цАМФ)
Наиболее изучен циклический 3", 5"-аденозинмонофосфат (цАМФ) — белый порошок, хорошо растворимый в воде. цАМФ открыт в 1957 американским биохимиком Э. Сазерлендом с сотрудниками при исследовании механизма активации фермента печени гормонами глюкагоном и адреналином. В тканях животных и человека цАМФ служит посредником в осуществлении многообразных функций различных гормонов и др. биологически активных соединений (некоторых медиаторов, токсинов, лактинов). У бактерий при недостатке в среде легкоусвояемых соединений, например увеличивается содержание цАМФ в клетке, что приводит к биосинтезу адаптивных (индуцируемых) ферментов, необходимых для усвоения др. источников питания. Уровень цАМФ в клетках сальмонеллы Salmonella thyphimurium определяет будущее попавшего в нее фага (при высокой концентрации цАМФ происходит лизогенизация культуры бактерий, при низкой — фаг вызывает ее лизис). У миксоамебы Dictyostelium discoideum цАМФ играет роль аттрактанта, привлекающего клетки друг к другу. У высших растений цАМФ опосредует влияние фитохрома на синтез пигментов бетационинов (у Amaranthus paniculatus).
Концентрация цАМФ в тканях млекопитающих очень мала и составляет десятые доли микромоля на 1 кг сырой ткани (10-7—10-6 моль). При активации аденилатциклазы, катализирующей биосинтез цАМФ, или блокировании фосфодиэстеразы, осуществляющей гидролиз этого нуклеотида, концентрация цАМФ в клетке быстро увеличивается. Т. о., содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. сигналом (первый "посредник") и цАМФ (второй "посредник") осуществляет т. н. аденилатциклазный комплекс, включающий рецептор, настроенный на определенный гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, во многих случаях активизирует аденилатциклазу, которая катализирует биосинтез цАМФ. Концентрация цАМФ, образующегося т. о. в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цАМФ в тканях животных и человека лежит его взаимодействие с — ферментами, активность которых проявляется в присутствии этого нуклеотида (см. схему). Связывание цАМФ с регуляторной субъединицей приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна определенные (в т. ч. ферменты). Изменение свойств этих макромолекул путем меняет и соответствующие функции клеток. Например, при действии адреналина на клетки печени происходит двух ферментов — и гликогенсинтетазы. при этом активируется, что приводит к быстрому гидролизу гликогена — запасного вещества печени. Одновременно с началом гидролиза гликогена прекращается его новый синтез, т.к. фермент, участвующий в его образовании, — гликогенсинтетаза при его теряет свою активность. Один и тот же гормон, действуя через посредство цАМФ, в разных тканях вызывает различные функциональные ответы, зависящие от особенностей данной ткани. При стрессе, когда потребность в энергии очень велика, мозговой слой надпочечников в повышенном количестве образует гормон адреналин. В печени адреналин обусловливает активное расщепление ( гликогена, образование эфиров и выброс в кровь большого количества в жировой ткани — приводит к гидролизу липидов, достигнув сердца, — увеличивает силу сокращения сердечной мышцы, усиливает кровообращение и улучшает питание тканей, осуществляя мобилизацию всех сил организма. цАМФ играет определенную роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др. Некоторые медиаторы, например ацетилхолин, могут ускорять образование др. Циклические нуклеотиды — 3",5"-гуанозинмонофосфата (цГМФ), который синтезируется в клетке из гуанозинтрифосфата при активации фермента гуанилатциклазы, входящей в гуанилатциклазный комплекс, расположенный в клеточной мембране. Характерно, что многие эффекты цГМФ прямо противоположны эффектам цАМФ. Антагонистические отношения Циклические нуклеотиды проявляются чаще всего в сложных системах, когда для регуляции клеточной функции требуется разновременная модификация многих осуществляемая согласованным действием попеременно активируемых цАМФ- и цГМФ-зависимых У бактерий цАМФ, соединившись с неферментным рецепторным присоединяется к ДНК и позволяет ферменту РНК-полимеразе начать транскрипцию гена, ответственного за синтез индуцируемого фермента (см. Оперон). Т. о., механизм действия цАМФ у бактерий и в тканях животных и человека принципиально различен. Исследования роли Циклические нуклеотиды в живых клетках — одно из наиболее быстро развивающихся направлений в биохимии, уже внесшее существенный вклад в понимание механизмов биологической регуляции на молекулярном уровне.
Лит.: Боннер Дж., Гормоны миксомицетов и млекопитающих, в кн.: Молекулы и клетки, пер. с англ., в. 5, М., 1970; Васильев В. Ю., Гуляев Н. Н., Северин Е. С., Циклический аденозинмонофосфат — биологическая роль и механизм действия, "Журнал Всесоюзного общества им. Д. И. 1975, т. 20, № 3; Доман Н. Г., Феденко Е. П., Биологическая роль циклического АМФ, "Успехи биологической химии", 1976, т. 17; Федоров Н. А., Циклический гуанозинмонофосфат (цГМФ): метаболизм и его биологическая роль, "Успехи современной биологии", 1976, т. 82, в. 1 (4); Sutherland Е. ., Roil Т. ., The properties of an adenine ribonucleotide produced with cellular particles, ATP, + + and epinephrine or glucagon, "Journal of the American Chemical Society", 1957, v. 79, № 13; Advances in cyclic nucleotide research, v 1—6 . . Amst., 1972—75.
Е. П. Феденко.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:50:53
|

|

|
 |
|

|
 |
 |
 |
|