
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Цепные реакции | Цепные реакции (далее Ц) и ядерные реакции, в которых появление промежуточной активной частицы (свободного радикала, или возбужденной молекулы - в нейтрона - в ядерных процессах) вызывает большое число (цепь) превращений исходных молекул или ядер вследствие регенерации активной частицы в каждом элементарном акте реакции (в каждом звене цепи). О ядерных процессах см. Ядерные цепные реакции.
В изученных неразветвленных Ц активные центры - свободные и радикалы, способные легко, с малой энергией активации реагировать с исходными молекулами, порождая наряду с молекулой продукта также новый активный центр. В разветвленных Ц в качестве активных центров могут выступать также возбужденные молекулы, а в т. н. вырожденно-разветвленных реакциях (см. ниже) - также нестабильные молекулы промежуточных веществ.
Неразветвленные Ц процессы с неразветвленными цепями можно рассмотреть на примере фотохимической реакции между и В этой Ц молекула поглощая квант света, распадается на два Каждый из образовавшихся начинает цепь превращений; в этой цепи и выступают в качестве активных частиц. Длина цепи может быть очень большой - число повторяющихся элементарных реакций продолжения цепи на один зародившийся активный центр может достигать десятков и сотен тысяч. Обрыв цепей происходит в результате рекомбинации в объеме реактора, захвата его стенкой с последующей рекомбинацией на стенке, образования неактивного радикала при реакции активных центров с молекулами всегда присутствующих примесей (например, при реакции между и молекулами (примесями) с образованием радикала 2; этот радикал в условиях не очень высоких температур не реагирует с исходными молекулами).
Реакцию между 2 и 2, вызванную действием кванта света hn, можно представить схемой:
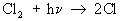 - зарождение цепи - зарождение цепи
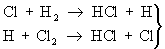 - продолжение цепи - продолжение цепи
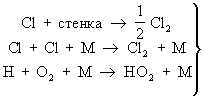 - обрыв цепи - обрыв цепи
В последних двух стадиях М - любая третья частица ( или молекула), которая нужна для того, чтобы отнять часть энергии у образующихся частиц 2 и 2 и тем самым сделать невозможным их обратный распад.
Скорость Ц чрезвычайно чувствительна к скоростям зарождения и обрыва и поэтому зависит от наличия примесей, от материала и состояния стенок реакционного сосуда, а также от его размера и формы.
Скорость реакций с неразветвленными цепями () равна<
= w0n = w0 п /oбр
где w0 - скорость зарождения цепей, n - длина цепей, п и oбр - соответственно скорости продолжения и обрыва цепей (oбр может быть составной величиной, отражающей различные пути обрыва цепи).
По неразветвленно-цепному механизму протекает большое число практически важных реакций, в частности хлорирование, ряд реакций жидкофазного окисления органических соединений, термический крекинг. Своеобразным процессом с неразветвленными цепями является также полимеризация, при которой цепь реакций одновременно определяет и длину полимерной молекулы.
Образование активных частиц, необходимых для зарождения цепей, происходит при разрыве одной из связей в молекуле и всегда сопряжено с затратой энергии. Свободные радикалы можно получать за счет внешних источников энергии, например кванта света, поглощаемого молекулой при фотохимической реакции, а также энергии электронов, образующихся в электрическом разряде или воздействии a-, b- и g-излучения. Наиболее важно в практическом отношении образование свободных радикалов за счет внутренней тепловой энергии системы. Но энергия связи в большинстве молекул велика и, значительно велика энергия их прямой диссоциации на радикалы, поэтому путем непосредственного распада исходных молекул Ц инициируются лишь при более или менее высоких температурах. Часто, однако, зарождение цепей происходит при участии различных примесей-инициаторов. Такими примесями могут быть молекулы со слабой связью, при распаде которых легко образуются радикалы, начинающие цепи, или молекулы, легко вступающие в окислительно-восстановительные реакции, например 2+ + 22 ® 3+ + - + . Инициирование может происходить также на стенке реакционного сосуда. Энергия активации при этом понижается благодаря тому, что в системе используется энергия адсорбции одного из радикалов. Цепи могут зарождаться и в результате реакций между молекулами. Некоторые из таких реакций протекают достаточно быстро даже при невысоких температурах, например 2 + 24 ® + 24.
Концепция неразветвленных Ц возникла в результате работ немецкого ученого М. Боденштейна, обнаружившего (1913), что в ряде фотохимических реакций один поглощенный квант света вызывает превращение многих молекул. В частности, при образовании из 2 и 2 в среднем на каждый поглощенный квант образуется до 1 000 000 молекул . Поскольку один квант может активировать только одну молекулу, остальные вступают в реакцию без непосредственного воздействия света. Механизм этой реакции предложил В. Нернст (1916).
Современная теория реакций с неразветвленными цепями была создана и развита школой Боденштейна, а также трудами советских ученых.
Реакции с разветвленными цепями. Совершенно особыми свойствами обладают реакции, в которых цепи разветвляются. Эти реакции были обнаружены в 1926-28 группой ленинградских физиков на примере окисления паров Было установлено, что при малом изменении какого-либо параметра реакционной системы (концентрации реагентов, температуры, размера сосуда, примесей специфических веществ) и даже при разбавлении инертным газом практически незаметная реакция скачкообразно переходит в быстрый, самоускоряющийся процесс типа самовоспламенения. Это явление имеет место даже при низких температурах, когда скорость зарождения подобных процессов чрезвычайно мала, а также в условиях, когда тепловой взрыв невозможен. Поэтому вне области воспламенения (см. рис.) реакция практически не идет. Н. Н. Семеновым с сотрудниками впервые было дано объяснение этого парадоксального факта и создана количественная теория разветвленных Ц Значительный вклад в развитие представлений о разветвленных Ц внесли также пионерские работы С. Н. Хиншелвуда с сотрудниками по изучению верхнего предела воспламенения. За исследования механизма реакций Семенову и Хиншелвуду была присуждена в 1956 Нобелевская премия.
В ходе разветвленных Ц при взаимодействии одного из активных центров возникает более чем один (часто - три) новый активный центр, т. е. происходит размножение цепей.
Примером разветвленной Ц может служить окисление где разветвление и продолжение цепей происходит по схеме:
(1) Н + 2 ® + О - разветвление
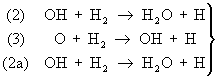 - продолжение - продолжение
или в сумме Н + 32 + 2 = 22 + 3.
Наряду с образующимися в реакциях 1-3 активными центрами Н и , обеспечивающими развитие неразветвленной цепи, в реакции (1) образуется формально обладающий двумя свободными валентностями и способный легко входить в реакцию (3) с образованием Н и - еще двух носителей цепей. Такой тип разветвления был назван материальным.
В реакциях с т. н. энергетическим разветвлением размножение цепей осуществляется за счет возбужденных частиц - продуктов экзотермических реакций развития цепи. Например, при взаимодействии с развитие цепей происходит по схеме:
(1) 2 ® 2
(2) + 2 ® * + Н
(3) Н + 2 ® * +
(4) * + 2 ® + 2*
(5) 2* + 2 ® + +
В реакциях (2) и (3) наряду с Н и образуются колебательно-возбужденные молекулы *, которые передают избыток энергии молекуле 2 (реакция (4)). В результате столкновения обогащенной энергией молекулы 2* с молекулой 2 образуется молекула и Н и (реакция (5)), начинающие новые цепи (энергетическое разветвление). В СССР получены экспериментальные данные (1970-е гг.), которые, по-видимому, можно рассматривать как подтверждение высказанной Семеновым идеи (1934) о возможности энергетического разветвления с участием электронно-возбужденных частиц.
Скорость разветвленно-цепного процесса в газовой фазе в начальных стадиях (вплоть до выгорания 30-40% газа) выражается формулой
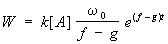
где k - константа скорости реакции активного центра с исходным веществом, (А) - концентрация исходного вещества, w0 - скорость зарождения цепей, f и g - соответственно эффективные константы скорости разветвления и обрыва, e - основание натурального логарифма, t - время.
В условиях, когда (f - g) > 0, концентрация активных центров и скорость растут лавинообразно во времени. Если же (f - g) < 0, то концентрации активных центров и соответственно скорость реакции очень малы, т.к. мала скорость зарождения цепей wo. Переход от одного режима реакции к другому осуществляется практически скачком при критическом условии (f - g) = 0.
Скорость разветвления цепей пропорциональна концентрации молекулярного реагента, вступающего в эту реакцию с активным центром. В то же время скорость гетерогенного обрыва цепей на стенке сосуда в зависимости от состояния его поверхности может не зависеть от концентрации или уменьшаться с ростом концентрации газофазной смеси. Поэтому при повышении давления, начиная с определенного его значения (первый предел), f становится больше g и происходит самовоспламенение смеси. Если обрыв цепей протекает при тройных столкновениях, то его скорость пропорциональна произведению суммарной концентрации смеси и концентрации исходного реагента, образующего с активным центром малоактивный радикал. При дальнейшем повышении давления, начиная с определенного его значения (верхний предел), обрыв превалирует над разветвлением (f < g), и воспламенения не происходит. Давление, при котором f = g, называется критическим давлением.
По аналогичным причинам для разветвленных Ц существует и критическая температура самовоспламенения. Поскольку скорость разветвления зависит от температуры сильнее, чем скорости обрыва, с повышением температуры область воспламенения расширяется.
Кривые, выражающие критическое давление как функцию температуры, имеют вид т. н. полуострова цепного воспламенения (см. рис.). В качестве примера приведены полуострова воспламенения для окисления силана при различном его содержании в Аналогичная картина наблюдается практически для всех реакций окисления и многих реакций Экспериментально наблюдаемые зависимости полностью соответствуют теории.
При гетерогенном обрыве величина g, а значит и скорость гибели активных центров, пропорциональна отношению внутренней поверхности сосуда к его объему, т. е. обратно пропорциональна диаметру сосуда. Соответственно существует критический диаметр. При диаметрах чуть больших критического реакция идет с воспламенением, при меньших - реакция фактически отсутствует. Если для смесей значения f и g близки друг к другу, но все же f < g, то такие смеси можно воспламенить, добавляя инертный газ. Добавление инертного газа при неизменной концентрации реагентов затрудняет диффузию активных центров к стенкам сосуда и этим уменьшает скорость обрыва (величину g).
Если в системе присутствует примесь вещества, в реакции с которым активные центры погибают, то выше некоторой критической концентрации этого вещества обрыв цепей превалирует над разветвлением и смесь не воспламеняется. Ниже этой критической концентрации примеси может происходить воспламенение смеси. Теория позволяет рассчитать изменение концентраций активных центров во времени. Расчеты показывают, что вблизи максимума скорости цепного процесса концентрации активных центров могут достигать огромных величин, намного превышающих их термодинамически равновесные концентрации (очевидно, что к концу процесса концентрации активных центров становятся исчезающе малыми из-за рекомбинации и радикалов). Действительно, в соответствии с теорией в различных разветвленных Ц непосредственно обнаружены и радикалы в концентрациях, сравнимых с концентрациями исходных веществ. Так, в процессе распада 3 при комнатной температуре и низких давлениях концентрации промежуточных активных частиц - - достигают 40% от начального содержания 3.
В 1939 В. Н. Кондратьевым с сотрудниками при изучении пламени, а затем Н. М. Эмануэлем на примере сероводородно- пламени впервые было показано, что концентрации активных центров в пламенах на много порядков превышают их термодинамически равновесные значения. Позднее для идентификации и радикалов в пламенах В. В. Воеводским с сотрудниками был впервые успешно использован метод электронного парамагнитного резонанса. Этот метод широко применяется при изучении различных разветвленных Ц
Не исключено, что область процессов, протекающих по цепному разветвленному механизму, шире, чем обычно предполагается, и здесь много еще неисследованного. Известно, например, что при большой скорости рекомбинации активных центров между собой процессы с разветвленными цепями могут имитировать закономерности реакций простых типов. В этих условиях цепной механизм нелегко установить. Это удалось сделать, например, в реакции жидкофазного окисления соединений двухвалентного
Критические явления, в известной мере аналогичные описанным выше, наблюдаются в некоторых гетерогенно-каталитических реакциях.
Разветвленные Ц - это не только и ядерные реакции. Явление когерентного излучения лазера, например, также относится к числу разветвленных цепных процессов.
Вырожденно-разветвленные Ц Реакции этого типа были предсказаны, открыты и затем подробно исследованы в институте физики АН СССР. При развитии неразветвленных цепей часто образуется промежуточный молекулярный продукт типа перекисей, который сравнительно легко, но все же не слишком быстро распадается на свободные радикалы, начинающие дополнительные новые цепи. В этом случае имеет место сильно запаздывающее разветвление и идет медленная автоускоряющаяся реакция, названная вырожденно-разветвленной. Такие реакции сопровождаются продолжительным, иногда часовым периодом индукции (вернее, периодом скрытого автоускорения). К ним относится окисление углеводородов и многих др. органических соединений. Многим вырожденно-разветвленным реакциям в газовой и в жидкой фазах также свойственны предельные (критические) явления, но проявляются они не столь часто, как в обычных разветвленных Ц Своеобразные реакции типа вырожденно-разветвленных протекают и в твердых телах, например при медленном термическом разложении перхлората аммония. В непосредственное разложение исходных веществ крайне затруднено и начинается на дефектах, прежде всего на дислокациях, вдоль которых образуются конечные вещества - газы или твердые продукты. При реакциях в дислокациях возникают механические напряжения, порождающие новые дислокации; т. о. идет их размножение, которое можно уподобить вырожденно-разветвленной Ц
Открытие разветвленных и вырожденно-разветвленных Ц имело исключительно большое значение для создания теории процессов горения. Было доказано, что существуют только два типа воспламенения: цепное и тепловое. Теория цепных процессов лежит в основе управления процессами горения и играет большую роль в различных областях современной техники.
Лит.: Семенов Н. Н., Ц, (Л.), 1934; его же, О некоторых проблемах кинетики и реакционной способности, 2 изд., М., 1958; его же, Развитие теории цепных реакций и теплового воспламенения, М., 1969; его же. On the possible importance of excited states in the kinetics of chain reactions, в кн.: Douziéme conseil de chimie tenu a L"Université Libre de Bruxelles, . . - Brux., 1962; Hinshelwood . ., The kinetics of chemical change, Oxf., 1942; Налбандян А. Б., Воеводский В. В., Механизм окисления и горения М. - Л., 1948; Эмануэль Н. М., Денисов Е. Т., Майзус З. К., Ц окисления углеводородов в жидкой фазе, М., 1965; Капралова Г. А. (и др.), Экспериментальные доказательства разветвлений в цепных реакциях молекулярного "Кинетика и катализ", 1963, т. 4, в. 4; Семенов Н. Н., Шилов А. Е., О роли возбужденных частиц в разветвленных цепных реакциях, "Кинетика и катализ", 1965, т. 6, в. 1; Кондратьев В. Н., Спектроскопическое изучение газовых реакций, М. - Л., 1944; Экспериментальные доказательства разветвлений в цепных реакциях молекулярного "Кинетика и катализ", 1963, т. 4, в. 4; Азатян В. В., Бородулин Р. Р., Маркович Е. А., Идентификация в разреженном пламени треххлористого "Кинетика и катализ", 1974, т. 15, в. 6.
Н. Н. Семенов.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:56:24
|

|

|
 |
|

|
 |
 |
 |
|