
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Цезий | (далее Ц)(лат. Caesium), , элемент группы периодической системы номер 55, масса 132, 9054; металл, относится к щелочным металлам. В природе встречается в виде стабильного изотопа 133. Из искусственно полученных радиоактивных изотопов с массовыми числами от 123 до 142 наиболее устойчив 137 с периодом полураспада T1/2 = 33 г.
Историческая справка. Ц открыт в 1860 Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюркхеймского минерального источника ( методом спектрального анализа. Назван Ц (от лат. caesius — небесно-голубой) по двум ярким линиям в синей части спектра. Металлический Ц впервые выделил шведский химик К. Сеттерберг в 1882 при электролизе расплавленной смеси и .
Распространение в природе. Ц — типичный редкий и рассеянный элемент (см. Рассеянные элементы, Редкие металлы). Среднее содержание Ц в земной коре (кларк) 3,7×10-4% по массе. В ультраосновных горных породах содержится 1×10-5% Ц в основных — 1×10-4%. Ц геохимически тесно связан с гранитной магмой, образуя концентрации в пегматитах вместе с , , , ; в особенности в пегматитах, богатых (альбитом) и (лепидолитом). Известно 2 крайне редких минерала Ц — поллуцит и авогадрит (К, ) ()4; наибольшая концентрация Ц в поллуците (26—32% 2). Большая часть Ц изоморфно замещает К и в полевых шпатах и слюдах. Примесь Ц встречается в берилле, карналлите, вулканическом стекле. Слабое обогащение Ц установлено в некоторых термальных водах. В целом Ц — слабый водный мигрант. Основное значение в истории Ц имеют процессы изоморфизма и сорбции крупных катионов Ц В геохимическом отношении Ц близок к и К, отчасти к .
Физические и свойства. Ц — очень мягкий металл; плотность 1,90 г/см3 (20 °С); tпл 28,5 °С; tкип 686 °С. При обычной температуре в кубической объемноцентрированной решетке (а = 6,045 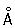 ). радиус 2,60 ). радиус 2,60 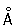 , ионный радиус + 1,86 , ионный радиус + 1,86 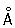 . Удельная теплоемкость 0,218 кдж/(кг×К) (0,052 кал/(г×оС)); удельная теплота плавления 15,742 кдж/кг (3,766 кал/г); удельная теплота испарения 610,28 кдж/кг (146,0 кал/г); температурный коэффициент линейного расширения (0—26 °С) 9,7×10-5; коэффициент теплопроводности (28,5°С) 18,42 вт/(м×К) (0,44 кал/(см×сек×°С)); удельное электросопротивление (20 °С) 0,2 мком×м; температурный коэффициент электросопротивления (0—30 °С) 0,005. Ц диамагнитен, удельная восприимчивость (18 °С) — 0,1×10-6. Динамическая вязкость 0,6299 Мн×сек/м2 (43,4°С), 0,4065 Мн×сек/м2 (140,5 °С). Поверхностное натяжение (62 °С) 6,75×10-2 н/м (67,5 дин/см); сжимаемость (20 °С) 7,05 Мн/м2 (70,5 кгс/см2). Энергия ионизации 3,893 эв; стандартный электродный потенциал — 2,923 в, работа выхода электронов 1,81 эв. Твердость по Бринеллю 0,15 Мн/м2 (0,015 кгс/см2). Конфигурация внешних электронов Ц 6s1; в соединениях имеет степень окисления + 1. . Удельная теплоемкость 0,218 кдж/(кг×К) (0,052 кал/(г×оС)); удельная теплота плавления 15,742 кдж/кг (3,766 кал/г); удельная теплота испарения 610,28 кдж/кг (146,0 кал/г); температурный коэффициент линейного расширения (0—26 °С) 9,7×10-5; коэффициент теплопроводности (28,5°С) 18,42 вт/(м×К) (0,44 кал/(см×сек×°С)); удельное электросопротивление (20 °С) 0,2 мком×м; температурный коэффициент электросопротивления (0—30 °С) 0,005. Ц диамагнитен, удельная восприимчивость (18 °С) — 0,1×10-6. Динамическая вязкость 0,6299 Мн×сек/м2 (43,4°С), 0,4065 Мн×сек/м2 (140,5 °С). Поверхностное натяжение (62 °С) 6,75×10-2 н/м (67,5 дин/см); сжимаемость (20 °С) 7,05 Мн/м2 (70,5 кгс/см2). Энергия ионизации 3,893 эв; стандартный электродный потенциал — 2,923 в, работа выхода электронов 1,81 эв. Твердость по Бринеллю 0,15 Мн/м2 (0,015 кгс/см2). Конфигурация внешних электронов Ц 6s1; в соединениях имеет степень окисления + 1.
Ц обладает очень высокой реакционной способностью. На воздухе мгновенно воспламеняется с образованием пероксида 22 и надпероксида 2; при недостатке воздуха получается оксид 2; известен также озонид 3. С водой, галогенами, углекислым газом, серой, четыреххлористым Ц реагирует со взрывом, давая соответственно гидроксид , галогениды, оксиды, сульфиды, . С взаимодействует при 200—350 °С и давлении 5—10 Мн/м2 (50—100 кгс/см2), образуя гидрид. Выше 300 °С Ц разрушает стекло, кварц и др. материалы, а также вызывает коррозию металлов. Ц при нагревании соединяется с (25), (), графитом (8 и 24). При взаимодействии Ц со щелочными и щелочноземельными металлами, а также с , , и образуются сплавы; с ацетиленом — ацетиленид 22. Большинство простых солей Ц особенно , , 23, 24, 24, хорошо растворимы в воде; малорастворимы 4, 4 и 227. Ц не принадлежит к числу комплексообразующих элементов, но он входит в состав многих комплексных соединений в качестве катиона внешней среды.
Получение. Ц получают непосредственно из поллуцита методом вакуумтермического восстановления. В качестве восстановителей используют , , и др. металлы.
Различные соединения Ц также получают путем переработки поллуцита. Сначала руду обогащают (флотацией, ручной рудоразработкой и т.п.), а затем выделенный концентрат разлагают либо кислотами 24, 3 и др.), либо спеканием с оксидно-солевыми смесями (например, с 2). Из продуктов разложения поллуцита Ц осаждают в виде CsAI (4)2×122, 3(29) и др. малорастворимых соединений. Далее осадки переводят в растворимые соли (сульфат, иодид и др.). Завершающим этапом технологического цикла является получение особо чистых соединений Ц для чего применяют методы из растворов (l (l)2), 3(2l9), 2(6) и сорбцию примесей на окисленных активированных углях. Глубокую очистку металлического Ц производят методом ректификации. Перспективно получение Ц из отходов от переработки нефелина, некоторых слюд, а также подземных вод при добыче нефти; Ц извлекают экстракционными и сорбционными методами.
Хранят Ц либо в ампулах из стекла "пирекс" в атмосфере либо в стальных герметичных сосудах под слоем обезвоженного вазелинового или парафинового масла.
Применение. Ц идет для изготовления фотокатодов ( href="http://Cs-Caesium.info/" title="Caesium">цезиевых, Электровакуумных фотоэлементов, фотоэлектронных умножителей, электронно-оптических преобразователей (см. Электронные приборы, Фотоэлектронная эмиссия). Перспективно применение "цезиевой плазмы" в ионных ракетных двигателях, Ц — в магнитогидродинамических генераторах и в термоэмиссионных преобразователях энергии. Изотопы Ц применяют: 133 в квантовых стандартах частоты, 137 в радиологии. Резонансная частота энергетического перехода между подуровнями основного состояния 133 положена в основу современного определения секунды.
Б. Д. Степин.
в организме. Ц — постоянный микрокомпонент организма растений и животных. Морские водоросли содержат 0,01—0,1 мкг Ц в 1 г сухого вещества, наземные растения — 0,05—0,2. Животные получают Ц с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г Ц пресмыкающихся — 0,04, млекопитающих — 0,05. Главное депо Ц в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л. Ц относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
(137) — бета-гамма-излучающий радиоизотоп Ц один из главных компонентов радиоактивного загрязнения биосферы. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления 137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных 137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и северных американских водоплавающих птиц. В организме человека 137 распределен относительно равномерно и не оказывает значительного вредного действия.
Г. Г. Поликарпов.
Лит.: Плющев В. Е., Степин Б. Д., и технология соединений лития, и М., 1970; их же, Аналитическая и М., 1975; Коган Б. И., Названова В. А., Солодов Н. А., и М., 1971; Моисеев А. А., Рамзаев П. В., в биосфере, М., 1975; Mattsson ., Radionuclides in lichen, reindeer and man, Lund, 1972.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 17:04:59
|

|

|
 |
|

|
 |
 |
 |
|