
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Хром | (далее Х)(лат. Cromium), , элемент группы периодической системы номер 24, масса 51,996; металл голубовато-стального цвета.
Природные стабильные изотопы: 50 (4,31%), 52 (87,76%), 53 (9,55%) и 54 (2,38%). Из шести искусственных радиоактивных изотопов наиболее важен 51 (период полураспада T1/2 = 27,8 сут), который применяется как изотопный индикатор.
Историческая справка. Х открыт в 1797 Л. Н. Вокленом в минерале крокоите — природном 4. Название Х получил от греческого слова chroma — цвет, краска (из-за разнообразия окраски своих соединений). Независимо от Воклена Х был открыт в крокоите в 1798 немецким ученым М. Г. Клапротом.
Распространение в природе. Среднее содержание Х в земной коре (кларк) 8,3×10-3%. Этот элемент, вероятно, более характерен для мантии Земли, т.к. ультраосновные породы, которые, как полагают, ближе всего по составу к мантии Земли, обогащены Х (2×10-1%). Х образует массивные и вкрапленные руды в ультраосновных горных породах; с ними связано образование крупнейших месторождений Х (см. Хромовые руды). В основных породах содержание Х достигает лишь 2×10-2%, в кислых — 2,5×10-3%, в осадочных породах (песчаниках) — 3,5×10-3%, глинистых сланцах — 9×10-3%. Х — сравнительно слабый водный мигрант; содержание Х в морской воде 0,00005 мг/л.
В целом Х — металл глубинных зон Земли; каменные метеориты (аналоги мантии) тоже обогащены Х (2,7×10-1%). Известно свыше 20 минералов Х Промышленное значение имеют только хромшпинелиды (до 54% ); кроме того, Х содержится в ряде др. минералов, которые нередко сопровождают руды, но сами не представляют практической ценности (уваровит, волконскоит, кемерит, фуксит).
А. И. Перельман.
Физические и свойства. Х — твердый, тяжелый, тугоплавкий металл. Чистый Х пластичен. в объемноцентрированной решетке, а = 2 885 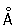 (20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решеткой, а = 3,69 (20 °С); при ~ 1830 °С возможно превращение в модификацию с гранецентрированной решеткой, а = 3,69 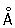 . .
радиус 1,27 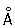 ; ионные радиусы 2+ 0,83 ; ионные радиусы 2+ 0,83 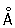 , 3+ 0,64 , 3+ 0,64 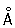 , 6+0,52 , 6+0,52 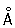 Плотность 7,19 г/см3; tпл 1890 °С; tкип 2480 °С. Удельная теплоемкость 0,461 кдж/(кг×К.) (0,11 кал/(г×°С)) (25°С); термический коэффициент линейного расширения 8,24×10-6 (при 20 °С); коэффициент теплопроводности 67 вм/(м×К) (0,16 кал/(см×сек×°С)) (20 °С); удельное электросопротивление 0,414 мком×м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10-3. Х антиферромагнитен, удельная восприимчивость 3,6×10-6. Твердость высокочистого Х по Бринеллю 7—9 Мн/м2 (70—90 кгс/см2). Плотность 7,19 г/см3; tпл 1890 °С; tкип 2480 °С. Удельная теплоемкость 0,461 кдж/(кг×К.) (0,11 кал/(г×°С)) (25°С); термический коэффициент линейного расширения 8,24×10-6 (при 20 °С); коэффициент теплопроводности 67 вм/(м×К) (0,16 кал/(см×сек×°С)) (20 °С); удельное электросопротивление 0,414 мком×м (20°С); термический коэффициент электросопротивления в интервале 20—600 °С составляет 3,01×10-3. Х антиферромагнитен, удельная восприимчивость 3,6×10-6. Твердость высокочистого Х по Бринеллю 7—9 Мн/м2 (70—90 кгс/см2).
Внешняя электронная конфигурация Х 3d5 4s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы 3+; известны отдельные соединения, в которых Х имеет степени окисления +1, +4, +5. Х малоактивен. При обычных условиях устойчив к и влаге, но соединяется с образуя 3. Выше 600 °С взаимодействует с парами воды, давая 23; — 2, ; — 236, 73, 32; серой — 23. При сплавлении с бором образует борид , с — силициды 3, 23, 2. Со многими металлами Х дает сплавы (см. Хромовые сплавы). Взаимодействие с протекает сначала довольно активно, затем резко замедляется благодаря образованию на поверхности металла окисной пленки. При 1200 °С пленка разрушается и окисление снова идет быстро. Х загорается в при 2000 °С с образованием темно-зеленой окиси Х 23. Помимо окиси, известны др. соединения с например , 3, получаемые косвенным путем (подробнее см. Хрома окислы). Х легко реагирует с разбавленными растворами соляной и серной кислот с образованием и сульфата Х и выделением царская водка и кислота пассивируют Х
С увеличением степени окисления возрастают кислотные и окислительные свойства Х Производные 2+ — очень сильные восстановители. Ион 2+ образуется на первой стадии растворения Х в кислотах или при восстановлении 3+ в кислом растворе Гидрат закиси ()2 при обезвоживании переходит в 42-. Соединения 3+ устойчивы на воздухе. Могут быть и восстановителями и окислителями. 3+ можно восстановить в кислом растворе до 2+ или окислить в щелочном растворе до 42- и др. окислителями. Гидроокись ()3 (вернее 23×nH2 — амфотерное соединение, образующее соли с катионом 3+ или соли кислоты 2 — (например, 2, 2). Соединения 6+: ангидрид 3, хромовые кислоты и их соли, среди которых наиболее важны хромоты и дихроматы (см. также Хромпик) — сильные окислители. Х образует большое число солей с кислотами. Известны комплексные соединения Х особенно многочисленны комплексные соединения 3+, в которых Х имеет координационное число 6. Существует значительное число перекисных соединений Х
Получение. В зависимости от цели использования получают Х различной степени чистоты. Сырьем обычно служат которые подвергают обогащению, а затем сплавляют с поташом (или содой) в присутствии воздуха. Применительно к основному компоненту руд, содержащему 3+, реакция следующая:
224 + 4К2СО3 + 3,52Х |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 23.02.2026 18:02:38
|

|

|
 |
|

|
 |
 |
 |
|