
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Хлор | (далее Х)(лат. Chlorum), , элемент группы периодической системы номер 17, масса 35,453; относится к семейству галогенов. При нормальных условиях (0°С, 0,1 Мн/м2 или 1 кгс/см2) желто-зеленый газ с резким раздражающим запахом. Природный Х состоит из двух стабильных изотопов: 35 (75,77%) и 37 (24,23%). Искусственно получены радиоактивные изотопы с массовыми числами 32, 33, 34, 36, 38, 39, 40 и периодами полураспада (T1/2) соответственно 0,31; 2,5; 1,56 сек; 3,1×105 лет; 37,3, 55,5 и 1,4 мин. 36 и 38 используются как изотопные индикаторы.
Историческая справка. Х получен впервые в 1774 К. Шееле взаимодействием соляной кислоты с пиролюзитом 2. Однако только в 1810 Г. Дэви установил, что — элемент и назвал его chlorine (от греч. chlorós — желто-зеленый). В 1813 Ж. Л. Гей-Люссак предложил для этого элемента название Х
Распространение в природ е. Х встречается в природе только в виде соединений. Среднее содержание Х в земной коре (кларк) 1,7×10-2% по массе, в кислых изверженных породах — гранитах и др. 2,4×10-2, в основных и ультраосновных 5×10-3. Основную роль в истории Х в земной коре играет водная миграция. В виде иона он содержится в Мировом океане (1,93%), подземных рассолах и соляных озерах. Число собственных минералов (преимущественно хлоридов природных) 97, главный из них галит (см. Каменная соль). Известны также крупные месторождения и и смешанных сильвин , сильвинит (, ) , карналлит ×2×62, каинит ×4×32, бишофит 2×62. В истории Земли большое значение имело поступление содержащегося в вулканических газах в верхние части земной коры.
Физические и свойства. Х имеет tkип —34,05°С, tnл —101°С. Плотность газообразного Х при нормальных условиях 3,214 г/л; насыщенного пара при 0°С 12,21 г/л; жидкого Х при температуре кипения 1,557 г/см3; твердого Х при — 102° 1,9 г/см3. Давление насыщенных паров Х при 0°С 0,369; при 25° 0,772; при 100° 3,814 Мн/м2 или соответственно 3,69; 7,72; 38,14 кгс/см2. Теплота плавления 90,3 кдж/кг (21,5 кал/г); теплота испарения 288 кдж/кг (68,8 кал/г); теплоемкость газа при постоянном давлении 0,48 кдж/(кг×К) (0,11 кал/(г×°С)). Критические константы Х температура 144°, давление 7,72 Мн/м2 (77,2 кгс/см2), плотность 573 г/л, удельный объем 1,745×10-3 л/г. Растворимость (в г/л) Х при парциальном давлении 0,1 Мн/м2, или 1 кгс/см2, в воде 14,8 (0°С), 5,8 (30°), 2,8 (70°); в растворе 300 г/л 1,42 (30°), 0,64 (70°). Ниже 9,6°С в водных растворах образуются гидраты Х переменного состава ×n2 (где n = 6¸8); это желтые кубической сингонии, разлагающиеся при повышении температуры на Х и воду. Х хорошо растворяется в 4, 14, 4 и некоторых органических растворителях (особенно в гексане 614 и четыреххлористом 4). Молекула Х двухатомна (2). Степень термической диссоциации 2 + 243 кдж Û 2 при 1000 К равна 2,07×10-40%, при 2500 К 0,909%. Внешняя электронная конфигурация 3s2 3p5. В соответствии с этим Х в соединениях проявляет степени окисления —1, +1, +3, +4, +5, +6 и +7. Ковалентный радиус 0,99 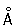 , ионный радиус - 1,82 , ионный радиус - 1,82 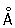 , сродство Х к электрону 3,65 эв, энергия ионизации 12,97 эв. , сродство Х к электрону 3,65 эв, энергия ионизации 12,97 эв.
Х очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и с неметаллами (кроме инертных газов), образуя соответствующие хлориды, вступает в реакцию со многими соединениями, замещает в предельных углеводородах и присоединяется к ненасыщенным соединениям. Х вытесняет и из их соединений с и металлами; из соединений Х с этими элементами он вытесняется Щелочные металлы в присутствии следов влаги взаимодействуют с Х с воспламенением, большинство металлов реагирует с сухим Х только при нагревании. Сталь, а также некоторые металлы стойки в атмосфере сухого Х в условиях невысоких температур, поэтому их используют для изготовления аппаратуры и хранилищ для сухого Х воспламеняется в атмосфере Х образуя 3, а при дальнейшем — 5; сера с Х при нагревании дает 22, 2 и др. nm. энергично взаимодействуют с Х Смесь Х с горит бесцветным или желто-зеленым пламенем с образованием хлористого водорода (это цепная реакция),
Максимальная температура пламени 2200°. Смеси Х с содержащие от 5,8 до 88,5% 2, взрывоопасны.
С Х образует окислы: 2, 2, 26, 27, 28 (см. Хлора окислы), а также гипохлориты (соли хлорноватистой кислоты), хлориты, хлораты и перхлораты. Все соединения образуют взрывоопасные смеси с легко окисляющимися веществами. Окислы Х малостойки и могут самопроизвольно взрываться, гипохлориты при хранении медленно разлагаются, и перхлораты могут взрываться под влиянием инициаторов.
Х в воде гидролизуется, образуя и соляную кислоты: 2 + 2 Û + . При водных растворов щелочей на холоду образуются гипохлориты и 2 + 2 = + + 2, а при нагревании — сухой гидроокиси получают хлорную известь.
При взаимодействии аммиака с Х образуется треххлористый (см. Хлориды азота). При органических соединений Х либо замещает R— + 2 = RCl + , либо присоединяется по кратным связям:
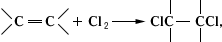 образуя различные органические соединения (см. Хлорирование). образуя различные органические соединения (см. Хлорирование).
Х образует с др. галогенами межгалогенные соединения. , 3, 5 очень реакционноспособны; например, в атмосфере 3 стеклянная вата самовоспламеняется. Известны соединения с и — оксифториды Х 3, 23, , 3 и перхлорат 4.
Получение. Х начали производить в промышленности в 1785 взаимодействием соляной кислоты с двуокисью или пиролюзитом. В 1867 английский химик Г. Дикон разработал способ получения Х окислением воздуха в присутствии катализатора. С конца 19 — начала 20 вв. Х получают электролизом водных растворов щелочных металлов. По этим методам в 70-х гг. 20 в. производится 90—95% Х в мире. Небольшие количества Х получаются попутно при производстве и лития электролизом расплавленных В 1975 мировое производство Х составляло около 25 млн. т. Применяются два основных метода электролиза водных растворов : 1) в электролизерах с твердым катодом и пористой фильтрующей диафрагмой; 2) в электролизерах с катодом. По обоим методам на графитовом или окисном href="http://Ru-Ruthenium.info/" title="Ruthenium">рутениевом аноде выделяется газообразный Х По первому методу на катоде выделяется и образуется раствор и , из которого последующей переработкой выделяют товарную каустическую соду. По второму методу на катоде образуется амальгама при ее разложении чистой водой в отдельном аппарате получаются раствор , и чистая которая вновь идет в производство. Оба метода дают на 1 т Х 1,125 т .
Электролиз с диафрагмой требует меньших капиталовложений для организации производства Х дает более дешевый . Метод с катодом позволяет получать очень чистый , но потери загрязняют окружающую среду. В 1970 по методу с катодом производилось 62,2% мировой выработки Х с твердым катодом 33,6% и пр. способами 4,2%. После 1970 начали применять электролиз с твердым катодом и ионообменной мембраной, позволяющий получать чистый без использования
Применение. Одной из важных отраслей промышленности является промышленность. Основные количества Х перерабатываются на месте его производства в соединения. Хранят и перевозят Х в жидком виде в баллонах, бочках, ж.-д. цистернах или в специально оборудованных судах. Для индустриальных стран характерно следующее примерное потребление Х на производство органических соединений — 60—75%; неорганических соединений, содержащих Х — 10—20%; на отбелку целлюлозы и тканей — 5—15%; на санитарные нужды и воды — 2—6% от общей выработки.
Х применяется также для некоторых руд с целью извлечения и др.
О органических соединениях см. Винилхлорид, Хлоропрен, Винилиденхлорид, Четыреххлористый углерод, Хлороформ, Метиленхлорид, Тетрахлорэтан, Трихлорэтилен, Хлорбензол и др. О неорганических соединениях см. Соляная кислота, Натрия хлорид, Калия хлорид, Кальция хлорид, Хлора окислы, Хлорная известь и др.
Л. М. Якименко.
Х в организме. Х — один из биогенных элементов, постоянный компонент тканей растений и животных. Содержание Х в растениях (много Х в галофитах) — от тысячных долей процента до целых процентов, у животных — десятые и сотые доли процента. Суточная потребность взрослого человека в Х (2—4 г) покрывается за счет пищевых продуктов. С пищей Х поступает обычно в избытке в виде и Особенно богаты Х хлеб, мясные и молочные продукты. В организме животных Х — основное осмотически активное вещество плазмы крови, лимфы, спинномозговой жидкости и некоторых тканей. Играет роль в водно-солевом обмене, способствуя удержанию тканями воды. Регуляция кислотно-щелочного равновесия в тканях осуществляется наряду с др. процессами путем изменения в распределении Х между кровью и др. тканями. Х участвует в энергетическом обмене у растений, активируя как окислительное фосфорилирование, так и фотофосфорилирование. Х положительно влияет на поглощение корнями Х необходим для образования в процессе фотосинтеза изолированными хлоропластами. В состав большинства питательных сред для искусственного культивирования растений Х не входит. Возможно, для развития растений достаточны весьма малые концентрации Х
М. Я. Школьник.
Отравления Х возможны в целлюлозно-бумажной, текстильной, фармацевтической промышленности и др. Х раздражает слизистые оболочки глаз и дыхательных путей. К первичным воспалительным изменениям обычно присоединяется вторичная инфекция. Острое отравление развивается почти немедленно. При вдыхании средних и низких концентраций Х отмечаются стеснение и боль в груди, сухой кашель, учащенное дыхание, резь в глазах, слезотечение, повышение содержания лейкоцитов в крови, температуры тела и т.п. Возможны бронхопневмония, токсический отек легких, депрессивные состояния, судороги. В легких случаях выздоровление наступает через 3—7 сут. Как отдаленные последствия наблюдаются катары верхних дыхательных путей, рецидивирующий бронхит, пневмосклероз и др.; возможна активизация туберкулеза легких. При длительном вдыхании небольших концентраций Х наблюдаются аналогичные, но медленно развивающиеся формы заболевания. Профилактика отравлений: герметизация производственного оборудования, эффективная вентиляция, при необходимости использование противогаза. Предельно допустимая концентрация Х в воздухе производственных помещений 1 мг/м3. Производство Х извести и др. соединений относится к производствам с вредными условиями труда, где по сов. законодательству ограничено применение труда женщин и несовершеннолетних.
А. А. Каспаров.
Лит.: Якименко Л. М., Производство каустической соды и неорганических М., 1974; Некрасов Б. В., Основы общей химии, 3 изд., (т.) 1, М., 1973; Вредные вещества в промышленности, под ред. Н. В, Лазарева, 6 изд., т. 2, Л., 1971; Comprehensive inorganic chemistry, ed. J. . Bailar (a. o.), v. 1—5, Oxf. — (a. o.), 1973.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 09.02.2026 13:08:08
|

|

|
 |
|

|
 |
 |
 |
|