
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Химическая связь | связь (далее Х) взаимное притяжение приводящее к образованию молекул и Принято говорить, что в молекуле или в между соседними существуют Х Валентность (о чем подробнее сказано ниже) показывает число связей, образуемых данным с соседними (см. также Валентность). Э. Франкленд в 1852 предложил концепцию, согласно которой каждый элемент образует соединения, связываясь с определенным числом эквивалентов др. элементов, при этом один эквивалент соответствует количеству, требуемому одной валентностью. Ф. А. Кекуле и А. В. Г. Кольбе в 1857 в соответствии с представлениями валентности выдвинули положение, что обычно имеет валентность 4, образует 4 связи с др. А. С. Купер в 1858 указал, что связываясь между собой, могут образовывать цепочки. В его записи формулы имели очень большое сходство с современными, связи изображались черточками, соответствующими валентным связям между Термин "химическое строение" впервые ввел А. М. Бутлеров в 1861. Он подчеркивал, сколь существенно выражать строение единой формулой, показывающей, как в молекуле соединения каждый связан с др. Согласно Бутлерову, все свойства соединения предопределяются его молекулярным строением; он высказал уверенность, что точную структурную формулу можно установить по результатам изучения путей синтеза данного соединения. Следующий шаг, заключавшийся в приписывании молекулам пространственной трехмерной структуры, был сделан в 1874 Я. Х. Вант-Гоффом и Ж. А. Ле Белем.
В 19 в. валентнаяХ изображалась черточкой между символами двух элементов. Природа этой связи была совершенно неизвестна. После открытия электрона делались многочисленные попытки развить электронную теорию Х Наиболее успешными были работы Г. Н. Льюиса, который в 1916 предложил рассматривать образование Х, называемой теперь ковалентнойХю, как результат того, что пара электронов становится общей для двух Разработка квантовой механики (1925) и использование многих экспериментальных методов (молекулярной спектроскопии, рентгенографии газовой электронографии, методов изучения свойств) для определения длин связей (межатомных расстояний), углов между связями, числа неспаренных электронов и других структурных параметров молекул и привели к более глубокому пониманию природы Х
Электронная структура Электронам в приписываются различные орбитали, которые характеризуются главным квантовым числом n, орбитальным квантовым числом l и квантовым числом ml (см. Квантовые числа, Квантовая химия). Имеется одна наиболее устойчивая орбиталь с n = 1, образующая К-оболочку. L-Оболочка с n = 2 включает одну орбиталь с l = 0 и ml = 0 и три с l = 1 и ml = -1, 0 и +1. Их называют 1s-орбиталь, 2s-орбиталь и три 2р-орбитали. М-Оболочка состоит из 3s-орбитали, трех 3р-орбиталей и пяти 3d-орбиталей. Электрон имеет спин со спиновым квантовым числом s = 1/2, который может ориентироваться относительно определенного направления двумя различными путями - с компонентами, даваемыми спиновым квантовым числом ms, равным + 1/2 или -1/2. В не может быть двух электронов с одинаковыми значениями всех квантовых чисел. Следовательно, 1s-орбиталь, образующая К-оболочку, может быть занята только одним электроном с положительным или отрицательным спином или же двумя электронами (электронной парой), одним - с положительным спином, другим - с отрицательным.
Заполнение определенных оболочек и подоболочек приводит к особой устойчивости наблюдающейся у инертных газов. В этих устойчивых структурах электронная конфигурация заполненной оболочки 1s2, 2s2 2p6, 3s2 3p6, криптона 3d10 4s2 4p6, 4d10 5s2 5p6, 4f14 5d10 6s2 6p6, эка- 5f14 6d10 7s2 7p6. (О заполнении электронных оболочек см. также Атом, Периодическая система элементов.)
КовалентнаяХ. В 1927 датский физик О. Бурро выполнил квантовомеханический расчет молекулярного нона и показал, что единственный электрон в этом ионе На занимает орбиталь, называемую молекулярной орбиталью, которая простирается вокруг обоих протонов. Теоретический расчет энергии связи этого молекулярного иона, т. е. разности между суммарной энергией отдельного и протона и энергией иона в его основном состоянии, привел к значению 255 кдж×моль-1, прекрасно согласующемуся с экспериментом. Вскоре было отмечено, что электронную структуру молекулярного иона можно рассмотреть, используя волновую функцию основного состояния По мере сближения и протона появляется возможность выхода электрона из области, окружающей одно ядро, в область, окружающую второе ядро, причем в каждом случае электрон занимает 1s-орбиталь. Молекулярная орбиталь, образованная как сумма этих двух 1s-орбиталей, является хорошим приближением к молекулярной орбитали, полученной Бурро путем решения волнового уравнения Шредингера. Если образовать волновую функцию как разность двух 1s-орбиталей, то это, как было показано, отвечает не притяжению, а отталкиванию. Первая волновая функция является симметричной линейной комбинацией двух 1s-функций и отвечает устойчивому состоянию, образованию одноэлектронной ковалентной связи, тогда как вторая функция, являющаяся антисимметричной линейной комбинацией тех же 1s-функций, отвечает неустойчивому состоянию. Иногда говорят, что образование одноэлектронной ковалентной связи в молекуле соответствует резонансу данного электрона между двумя орбиталями или между двумя
В том же году (1927) было выполнено два квантовомеханических расчета Х в молекуле Американский физик Э. У. Кондон использовал метод молекулярных орбиталей, приписав молекуле структуру, в которой за основу была принята орбиталь 2+, рассчитанная Бурро, причем к этой орбитали были отнесены оба электрона с противоположными спинами. Немецкие физики В. Гейтлер и Ф. Лондон отнесли один электрон, с положительным спином, к 1s-орбитали одного а второй, с отрицательным спином, к 1s-орбитали др. Волновая функция для данной молекулы была суммой этой функции и функции, в которой два электрона менялись местами - электрон с положительным спином относился ко второму а с отрицательным - к первому Оба расчета, как Кондона, так и Гейтлера и Лондона, привели к выводу об устойчивости молекулы с энергией связи, превышающей приблизительно в 1,7 раза энергию связи в молекулярном ионе Связь между двумя в молекуле - прототип связи с поделенной электронной парой по Льюису, обычно называют ковалентнойХю.
На основании формальных результатов квантовомеханического рассмотрения Х можно сделать следующий простой вывод: могут образовывать ковалентнуюХ (осуществляемую парой электронов) за счет каждой стабильной орбитали, занятой первоначально одним электроном; при этом образуетсяХ такого типа, как описанная выше для молекулы а ее стабильность может быть связана с тем же самым явлением резонанса. Иными словами, для образования ковалентной связи необходимо наличие двух электронов с противоположными спинами и по одной стабильной орбитали у каждого из двух связываемых
с единственной стабильной орбиталью (1s) может образовывать лишь одну ковалентнуюХ. и другие второго периода (бор, могут образовывать не более четырех ковалентных связей с использованием четырех орбиталей L-оболочки. Квантовомеханическое рассмотрение приводит также к выводу, что каждая дополнительнаяХ, образующаяся в молекуле, в общем случае ведет к дальнейшей стабилизации молекулы, а следовательно, наиболее устойчивы такие электронные структуры молекулы, в которых все стабильные орбитали либо использованы для образования связей, либо заполнены неподеленными парами электронов.
Метану 4, например, приписывается следующая структура валентных связей:
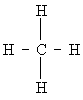
Черточки означают поделенные электронные пары. Можно сказать, что поделенная электронная пара занимает 1s-орбиталь каждого и одну из четырех орбиталей L-оболочки т. о., комплектуют завершенную К-оболочку (как в а который также имеет неподеленную пару 1s-электронов, комплектует завершенную L-оболочку (как в
Представление о гибридных орбиталях, формирующих связи, дает решение проблемы, волновавшей химиков и физиков в ранний период квантовой теории. Четыре орбитали L-оболочки делятся на два вида - 2s-орбиталь и три 2р-орбитали, а четыре связи как показывают свойства соединений оказываются одинаковыми. В действительности вместо 2s-орбитали и трех 2р-орбиталей может образовываться набор эквивалентных sp3-гибридных орбиталей, называется тетраэдрическими орбиталями; они направлены к вершинам правильного тетраэдра и обладают большей силой связи, чем s-орбиталь или р-орбиталь (Л. Полинг, 1931).
Для молекулы воды 2 можно записать следующую валентную структуру:
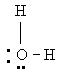
окружен двумя неподеленными парами электронов и двумя поделенными парами. 2s-Орбиталь несколько более стабильна, нежели 2р-орбитали, так что неподеленные электронные пары прежде всего заполняют 2s-орбиталь. Если бы две связи в молекуле воды были образованы р-орбиталями то угол между связями был бы равен 90°, поскольку при угле 90° друг относительно друга р-орбитали имеют максимальную силу связи. Расчеты показывают, что максимальная устойчивость достигается в том случае, когда орбитали, образующие связи в молекуле воды, в небольшой мере имеют также s-характер, соответственно валентный угол между связями несколько больший, чем 90°. Экспериментальное значение валентного угла в молекуле 2 104,5°, а валентные углы в гидридах 2, 2 и 2 равны 92, 91 и 90° соответственно.
Двойная ковалентнаяХ между имеется в этилене 24, а тройнаяХ - в ацетилене 22. Валентные структуры для этих молекул следующие:
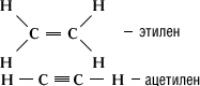
В образовании двойной связи участвуют две поделенные электронные пары, а в образовании тройной связи - три пары. В каждой из этих структур приобретает электронную конфигурацию будучи окружен четырьмя поделенными парами электронов. Можно сказать, что образует четыре одинарные (ординарные, простые) связи, направленные к вершинам тетраэдра. В двойной и тройной связях имеются две или три изогнутые связи. Интересно, что в этих случаях расстояния между равны соответственно 133 пм и 120 пм, что с точностью до 1 пм совпадает со значениями, соответствующими изогнутым связям при нормальной длине одинарной связи 154 пм в молекуле этана. Такое соответствие подтверждает правильность представления, что двойная и тройная связи могут быть описаны моделью изогнутых связей.
Энергия двойной связи на 73 кдж×моль-1 меньше, чем сумма энергий двух одинарных связей, энергия же тройной связи на 220 кдж×моль-1 меньше суммы энергий трех одинарных связей. Эти различия в устойчивости могут быть связаны с напряженностью изогнутых связей. Энергия напряжения благоприятствует превращению кратных связей в одинарные, и именно поэтому вещества с кратными связями легко присоединяют такие вещества принято называть ненасыщенными, а соответствующие соединения, имеющие только одинарные связи, например этан, называются насыщенными.
Резонанс и структура бензола. Правила построения валентных структур на основании представлений о поделенных парах электронов и использования устойчивой орбитали каждого из двух между которыми образуется ковалентнаяХ, позволяют написать структурные формулы для очень большого числа веществ, однако для некоторых веществ одна валентная структура не дает вполне адекватного представления о свойствах. Веществом именно такого рода является, например, озон 3. Спектроскопические исследования озона показали, что в его молекуле расположены под углом 117° (угол между связями у центрального а каждая из двух связей - имеет длину 128 пм. Есть все основания приписать молекуле озона следующую валентную структуру:
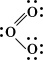
Эта структура представляется удовлетворительной, поскольку каждый из окружен четырьмя парами электронов, причем некоторые пары поделенные, а некоторые неподеленные. Однако если приписать формальные заряды разделив поделенные пары электронов поровну между двумя то центральный будет иметь положительный заряд, а связанный с ним одинарнойХю, - отрицательный. Такую электронную структуру нельзя считать вполне удовлетворительной, поскольку межатомное расстояние, отвечающее двойной связи, должно быть приблизительно на 21 пм меньше, чем расстояние для одинарной связи, тогда как согласно наблюдениям эти расстояния равны. Такое расхождение можно объяснить, приняв и вторую валентную структуру для данной молекулы:
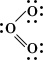
Приведенные структуры эквивалентны. При квантовомеханическом рассмотрении молекулы озона ей приписывается волновая функция, которая представляет собой сумму волновых функций для этих двух валентных структур. Установлено, что подобная волновая функция отвечает среднему значению длины связи, одному и тому же для обеих связей, и, кроме того, эта волновая функция соответствует большей стабильности, нежели каждая из волновых функций отдельных валентных структур. Такая дополнительная стабилизация описывается как энергия резонанса, соответствующая резонансу молекулы между двумя структурами. Отсюда следует, что озон нельзя удовлетворительно описать одной валентной структурой обычного типа, тогда как комбинация двух валентных структур приводит к удовлетворительному описанию молекулы в ее основном состоянии.
Этот факт не противоречит основному принципу, выдвинутому в 1861 Бутлеровым, - каждое вещество имеет определенное молекулярное строение, которое обусловливает свойства данного вещества (см. Химического строения теория, Электронные теории в органической химии). Молекула озона в ее основном состоянии имеет определенное единственное строение. Оно может быть представлено одной формулой:
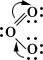
Стрелки в этой формуле показывают, что двойнаяХ и одинарнаяХ могут меняться местами. Структура с двойнойХю в одном положении и одинарнойХю в другом не представляет какого-либо состояния молекулы озона, однако две резонирующие валентные структуры вместе взятые или структурная формула, в которой символически показано, что двойная и одинарная связи меняются местами, дают приемлемое представление о действительном единственном строении молекулы озона в основном состоянии.
Аналогичная ситуация наблюдается при рассмотрении молекулы бензола, строение которой казалось химикам загадочным до разработки (1928-33) теории резонанса (называемая также мезомерией). Кекуле указывал, что четырехвалентность в бензоле можно показать с помощью структурной формулы с чередующимися простыми и двойными связями. Однако таких структур может быть две:
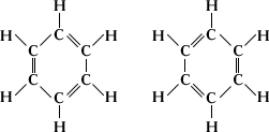
Были предприняты попытки обнаружить изомеры таких веществ, как о-дихлорбензол ( присоединены к связанным двойнойХю в случае первого изомера и одинарнойХю в случае второго). Однако обнаружить такие изомеры не удалось, и было признано, что все шесть связей в бензольном кольце эквивалентны друг другу. Детальное квантовомеханическое рассмотрение бензола показало. что его молекула имеет гексагональную симметрию и что все шесть связей эквивалентны. Этот факт позволяет сказать, что основное состояние молекулы бензола может быть представлено двумя структурами Кекуле, налагающимися одна на другую или резонирующими между собой. В соответствии с квантовомеханическими расчетами реальная молекула бензола должна быть приблизительно на 150 кдж×моль-1 устойчивее, нежели гипотетическая молекула, описываемая лишь одной структурой Кекуле. Эта дополнительная устойчивость обусловливает повышенную сопротивляемость бензола гидрогенизации по сравнению с обычными ненасыщенными соединениями.
Молекула бензола в ее основном состоянии может быть представлена единственной формулой, такой, как: 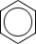 . Кружок, проведенный внутри шестиугольника, означает, что данная структура описывает реальную молекулу, то есть отвечает большей устойчивости по сравнению со структурой Кекуле, и отражает эквивалентность всех шести связей. И все же предпочтительнее бензол изображать двумя структурами Кекуле с оговоркой, что действительная структура молекулы соответствует резонансу между этими двумя структурами. Зная свойства, присущие одинарным связям и двойным связям, можно предсказать свойства, отвечающие структуре Кекуле и суперпозиции двух структур Кекуле. Длина одинарной связи 154 пм, а двойной связи - 133 пм. Для суперпозиции двух структур Кекуле ожидается среднее значение, более близкое, вследствие резонансной стабилизации, к значению для двойной связи. Наблюдаемое значение 140 пм согласуется с расчетным. Кроме того, если принять тетраэдрическую структуру каждого с деформированными (изогнутыми) двойными связями (общее ребро двух тетраэдров), можно предсказать, что молекула бензола должна быть плоской с в углах правильного шестиугольника и в углах большего правильного шестиугольника, лежащего в той же плоскости. Эти предсказания подтверждены опытными данными. . Кружок, проведенный внутри шестиугольника, означает, что данная структура описывает реальную молекулу, то есть отвечает большей устойчивости по сравнению со структурой Кекуле, и отражает эквивалентность всех шести связей. И все же предпочтительнее бензол изображать двумя структурами Кекуле с оговоркой, что действительная структура молекулы соответствует резонансу между этими двумя структурами. Зная свойства, присущие одинарным связям и двойным связям, можно предсказать свойства, отвечающие структуре Кекуле и суперпозиции двух структур Кекуле. Длина одинарной связи 154 пм, а двойной связи - 133 пм. Для суперпозиции двух структур Кекуле ожидается среднее значение, более близкое, вследствие резонансной стабилизации, к значению для двойной связи. Наблюдаемое значение 140 пм согласуется с расчетным. Кроме того, если принять тетраэдрическую структуру каждого с деформированными (изогнутыми) двойными связями (общее ребро двух тетраэдров), можно предсказать, что молекула бензола должна быть плоской с в углах правильного шестиугольника и в углах большего правильного шестиугольника, лежащего в той же плоскости. Эти предсказания подтверждены опытными данными.
ИоннаяХ. Расплавленный - хороший проводник электричества. Эту расплавленную соль можно считать состоящей из положительных ионов + и отрицательных ионов - в достаточно компактном состоянии, при котором в условиях термического равновесия каждый ион обладает возможностью медленно перемещаться. Под действием приложенного электрического поля ионы передвигаются в направлении отрицательного электрода, а ионы - в направлении положительного электрода, обусловливая проводимость электрического тока.
Ион + - это потерявший один электрон и приобретший устойчивую электронную конфигурацию а ион - - присоединивший один электрон и приобретший устойчивую электронную конфигурацию Формула определяется стабильностью этих ионов и условием электронейтральности данного вещества. Металлы первой группы периодической системы элементов образуют однозарядные ионы и, как принято говорить, имеют ионную валентность +1; металлы второй группы образуют двухзарядные ионы и имеют ионную валентность +2, и т.д. Аналогично галогены, элементы седьмой группы, присоединяют электрон и образуют однозарядные отрицательные ионы, т. е. имеют ионную валентность -1; и его аналоги могут присоединять два электрона с образованием двухзарядных отрицательных ионов со структурой инертных газов и обладают ионной валентностью -2, и т.д. Состав солей определяется ионными валентностями их катионов и анионов при соблюдении условия электронейтральности образующегося соединения.
Кулоновские силы, действующие между ионами, например + и -, приводят к тому, что каждый ион притягивает соседние ионы противоположного знака и создает из них окружение. В случае это приводит к устойчивому упорядоченному расположению, отвечающему структуре, при которой каждый ион имеет шесть ближайших соседей противоположного знака и двенадцать соседей того же знака, находящихся на расстоянии в 21/2 раза большем. Общая кулоновская энергия для такого расположения находится суммированием по парам ионов, и она равна -1,7476 e2/R для пары ионов +-, где R - расстояние между центрами ионов ближайших соседей, е - заряд иона. Следовательно, стабилизирован кулоновским притяжением, энергия такой системы на 75% превышает энергию системы положительных и отрицательных зарядов, находящихся на тех же расстояниях R друг от друга. Кулоновская энергия большая - она составляет около 860 кдж×моль-1, с учетом сродства к электрону затраты такой энергии более чем достаточно для сублимации металлического ионизации его и диссоциации молекул на а остальная энергия (410 кдж×моль-1) соответствует энергии образования из элементов.
Силы притяжения ионов противоположного заряда называются силами ионной валентности. Можно сказать, что в в котором ион имеет координационное число шесть (то есть он окружен шестью ближайшими соседями), общая ионная валентность иона +1 разделяется между соседями, при этом каждую из шести связей между и прилегающим можно рассматривать как ионнуюХ силой 1/6. Отрицательный заряд иона удовлетворяет шесть ионных связей, каждая силой 1/6, от шести соседних ионов Согласно правилу валентности, весьма существенному в неорганической химии, сумма ионных валентностей, направленных к каждому отрицательному иону, должна быть точно или приближенно равна ионной валентности данного отрицательного иона.
В ионных связи в действительности не являются чисто ионными. Они носят частично ковалентный характер, о чем сказано в следующем разделе.
Электроотрицательность и частично ионный характер связей. В 20-х гг. 20 в.. когда были развиты концепции ионной валентности и ковалентности, но еще не были известны основные принципы электронного строения и молекул, велась широкая дискуссия о том, как описывать молекулу, подобную - как имеющую ковалентнуюХ или как имеющую ионнуюХ. Структура +- представлялась удовлетворительной, поскольку было известно о существовании соответствующих ионов, а ион имеет устойчивую структуру Точно так же структура 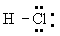 представлялась удовлетворительной, поскольку включала поделенную электронную пару, что создавало устойчивую конфигурацию для и устойчивую конфигурацию для в водном растворе диссоциирует на ионы и а это позволяет предполагать, что ионное строение может быть присущим молекуле и в газовой фазе. Диэлектрическая проницаемость газа, однако, соответствует электрическому дипольному моменту, составляющему лишь 19% величины, ожидаемой для ионной структуры при известном межатомном расстоянии 127 пм. Решение этой проблемы было найдено с помощью общей квантовомеханической теории молекулярного строения. Оно сводилось к тому, что действительное строение молекулы в основном состоянии может быть описано волновой функцией, представляющей собой сумму функций, отвечающих ионной структуре и ковалентной структуре. В случае молекулы Х может быть описана как ионная со значительной долей ковалентности или, лучше сказать, как ковалентнаяХ с небольшой долей (19%) ионности. представлялась удовлетворительной, поскольку включала поделенную электронную пару, что создавало устойчивую конфигурацию для и устойчивую конфигурацию для в водном растворе диссоциирует на ионы и а это позволяет предполагать, что ионное строение может быть присущим молекуле и в газовой фазе. Диэлектрическая проницаемость газа, однако, соответствует электрическому дипольному моменту, составляющему лишь 19% величины, ожидаемой для ионной структуры при известном межатомном расстоянии 127 пм. Решение этой проблемы было найдено с помощью общей квантовомеханической теории молекулярного строения. Оно сводилось к тому, что действительное строение молекулы в основном состоянии может быть описано волновой функцией, представляющей собой сумму функций, отвечающих ионной структуре и ковалентной структуре. В случае молекулы Х может быть описана как ионная со значительной долей ковалентности или, лучше сказать, как ковалентнаяХ с небольшой долей (19%) ионности.
Рассматриваемая молекула в ее основном состоянии имеет, конечно, единственное строение, которое может быть представлено единственной формулой Н-. В случае ковалентной связи между одинаковыми как в Н-Н или -, связывающая электронная пара поделена поровну между двумя Идеальная ковалентнаяХ может быть определена как такаяХ, в которой электронная пара поделена поровну между двумя даже если они не одинаковы. Если бы в осуществлялась идеальная ковалентнаяХ, то можно было бы ожидать, что ее энергия была бы средней между энергиями связей в 2 и 2. Действительно, для ряда одинарных связей между неодинаковыми энергия связи равна средней энергии, отвечающей связям между одинаковыми Примером может служить с энергией связи 299 кдж×моль-1, которая всего лишь на 5 кдж×моль-1 больше среднего значения для 2 (436) и 2 (151). Электрический. дипольный момент молекулы также близок к нулю, а это указывает на то, что поделенная электронная пара почти в равной мере относится к обоим Связь в молекуле может быть описана как ковалентная с очень малой степенью ионности. Когда жеХ имеет высокую степень ионности, энергия такой связи значительно превышает величину, отвечающую идеальной ковалентной связи; в случае она на 92 кдж×моль-1 больше. Эта величина, представляющая собой энтальпию образования из элементарных веществ, является энергией резонанса при 19% ионности, т. е. энергией, соответствующей резонансу между ионной структурой и идеальной ковалентной структурой.
Было установлено, что одинарные связи между неодинаковыми вообще несколько прочнее, чем средняя энергия соответствующих связей между одинаковыми и что этот выигрыш в энергии, энтальпии образования, в первом приближении пропорционален квадрату разности электроотрицательностей Значения электроотрицательности (х) могут быть приписаны элементам в соответствии с табл. (см.). Дополнительная энергия одинарной связи между неодинаковыми приблизительно равна произведению 100 кдж×моль-1 на квадрат разности их электроотрицательностей. Несколько лучшее приближение достигается с учетом члена в четвертой степени; тогда приближенное уравнение для энергии (Е) одинарной связи А-В (в кдж×моль-1) между различными А и В будет иметь вид:
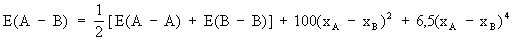
Для Н-, например, это уравнение при E ( - Н) = 436, E ( - ) = 243 и x - x = 0,9 дает значение 417 кдж×моль-1, которое на 4% меньше экспериментального значения 432 кдж×моль-1.
Наблюдаемые величины электрических дипольных моментов молекул показывают, что степень ионности связи А-В повышается с увеличением разности Dx = xA - x и составляет приблизительно 22% для Dх = 1,0, 63% для Dх = 2,0 и 89% для Dх = 3,0. Для , например, наблюдаемое значение электрического дипольного момента составляет 19% значения, соответствующего зарядам +2 и -2 при межъядерном расстоянии для молекулы 127 пм, что может быть сопоставлено со значением Dx = 0.9 для Н и .
Полная шкала электроотрицательности*
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.0
|
1.5
|
2.0
|
|
|
|
|
|
|
|
|
|
|
2.5
|
3.0
|
3.5
|
4.0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.9
|
1.2
|
1.5
|
|
|
|
|
|
|
|
|
|
|
1.8
|
2.1
|
2.5
|
3.0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.8
|
1.0
|
1.3
|
1.5
|
1.6
|
1.6
|
1.5
|
1.8
|
1.9
|
1.9
|
1.9
|
1.6
|
1.6
|
1.8
|
2.0
|
2.4
|
2.8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.8
|
1.0
|
1.2
|
1.4
|
1.6
|
1.8
|
1.9
|
2.2
|
2.2
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 09.02.2026 13:08:58
|

|

|
 |
|

|
 |
 |
 |
|
| |