
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Фторорганические соединения | соединения (далее Ф) органическоеФ, содержащие в молекулах одну или несколько связей —. Ф начала интенсивно развиваться лишь со 2-й половины 20 в., но уже выросла в большую специализированную область органической химии. Ее развитие было обусловлено потребностями молодой промышленности в материалах, стойких к действию 6, который применяется для изотопов разделения Известны всех типов органических соединений.
Номенклатура. Положение в Ф обозначают согласно правилам номенклатуры органических соединений (см. Номенклатура химическая). Для построения название полифторзамещенных соединений удобнее пользоваться приставкой "пер". Так, полностью углеводороды называются перфторуглеводородами (или например 3(2)53 называется перфторгептаном. Частично Ф можно рассматривать как производные перфторуглеводородов, например 3 (2) 2 называется 1,6-дигидроперфторгептаном. Очень часто в название Ф сочетание "перфтор" заменяют греческой буквой j; в этом случае, например, перфторэтан называется j-этаном. Для обозначения полностью углеводородов используют также частицу "фор" ( которую включают в наименование соответствующего углеводорода, например название 4 — метфоран, 26 — этфоран.
Методы синтеза. Прямое а также присоединение 2 по двойной связи — радикальные чрезвычайно экзотермические реакции:
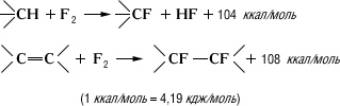
(1ккал/моль = 4,19 кдж/моль)
Т. к. тепловой эффект больше, чем разрыва С—С-связей (80—85 ккал/моль), возможна деструкция соединений. Во избежание этого необходим эффективный отвод тепла и разбавление смеси реагирующих веществ Для отвода тепла в реакционное пространство (трубка) вводят сетку или стружки, покрытые , , или др.; на поверхности сетки (стружек) образуются высшие металлов, которые и служат агентами, роль при этом сводится, по-видимому, к их регенерации.
В металлофторидном процессе пары вещества, сильно разбавленные пропускают через трубку с 3:
1/2 (—2—) + 2з ® 1/2(—2—) + + 22 + 46 ккал/моль.
Образующийся 3 действием при 250°С превращают опять в 3. Выходы перфторуглеводородов 80—85%.
Важен метод электрохимического Электролитом служит раствор вещества в безводном В случае неэлектропроводных соединений обычно добавляют . Этим методом j-амины, j-окиси и др. Все рассмотренные выше процессы применяются в промышленности.
Обмен на — важный промышленный метод введения (см. Свартса реакция); может быть произведен безводным или фторидами (например, 4, , CbF32, 2, 2. Легкость обмена зависит от строения Ф. Так, кислот часто легко превращаются во путем растворения их в безводном . в этиленхлоргидрине, кислоте и ее производных легко обмениваются на при реакции с в полярных растворителях (например, этиленгликоле); в моногалогенуглеводородах — лишь действием 2 или 2 при 150°С. Легче замещаются на вФх, содержащих трихлорметильную группу. В промышленности для такого обмена применяют обычно растворы 3 или 32 в безводном . Этим способом из 3 получают дифторхлорметан, используемый для производства тетрафторэтилена, из 4 — дифтордихлорметан (один из важнейших фреонов), из 26 — трифтортрихлорэтан (исходное вещество для производства трифторхлорэтилена).
Сравнительно легко на обмениваются в гексахлорбензоле (действием при 450—530°С); 66 и 65 при этом получаются с хорошими выходами. Аналогично реагируют и др. полихлорароматические и полихлоргетероциклическиеФ.
Диазометод получения соединений основан на образовании борфторида выделяют в твердом при нагревании:
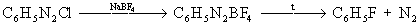
Замена группировок в различных органическихФх на при помощи 4 (например, в спиртах, альдегидах, кетонах, кислотах):
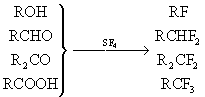
(R — органический остаток).
Присоединение безводного к олефинам, галогенолефинам, окисям, изоцианатам, циклопарафинам и др., например:
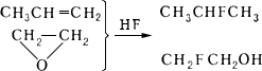
Сопряженное присоединение и др. или групп кФм, содержащим кратные связи, легко происходит в избытке безводного , например
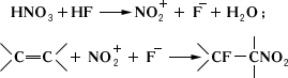
Методы получения Дегалогенирование вицинальных дигалогенполифторалканов металлами (, и др.), например:
2 — 2 + ® 2 = 2 + 2.
Пиролиз политетрафторэтилена, приводящий к образованию перфторпропилена и перфторизобутилена наряду с тетрафторэтиленом, перфторбутиленом, и др.:
(—2—) n ® 3 = 2 + (3)2 = 2 + 2 = 2 + 32 = 2 и др.
В промышленности этим способом (а также пиролизом тетрафторэтилена) получают перфторпропилен — важный мономер для производства
Пиролиз солей j-карбоновых кислот, например:
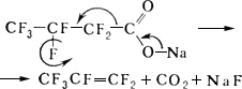
спирты получают обычными методами синтеза спиртов, например восстановлением эфиров j-карбоновых кислот, альдегидов и кетонов. Важный промышленный способ их получения — теломеризация тетрафторэтилена метанолом:
n2 = 2 + 3 ® Н (—22—) n СН2ОН.
Свойства. Физические свойства. Низшие парафинового ряда (общая формула n2n+2) — газы, начиная с 5 — жидкости, высшие — твердые воскообразныеФ. Только первые четыре представителя этого ряда кипят несколько выше соответствующих углеводородных аналогов, все остальные — ниже.
При замещении одного в молекуле углеводорода на температура кипения повышается, но меньше, чем при замене его на При полной замене на у любых производных углеводородов температуры кипения очень сильно понижаются (см. табл.).
Сравнение температур кипения некоторых соединений<
Формула
|
tкип, °С
|
Формула
|
tкип, °С
|
3
|
+78
|
3
|
-64
|
32
|
+102
|
32
|
-31
|
(2)4
|
+265
|
(2) 4
|
+63
|
322
|
+19
|
322
|
-34.3
|
33
|
+56
|
33
|
+29
|
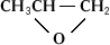
|
+35
|
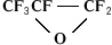
|
-28
|
— хорошие диэлектрики (удельное электрическое сопротивление около 1014 ом (см; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во необычайно низка (менее 800 м/сек).
свойства наиболее важных типов Ф парафинового и алициклических рядов характеризуются необычайно высокими инертностью и термостойкостью. Для них известно небольшое число реакций, осуществляемых лишь при высоких температурах. Так, пиролиз перфторэтана начинается около 1000°, перфторгептана — около 800°. не реагируют в обычных условиях и при умеренном нагревании с концентрированными кислотами, сильными окислителями, металлами, щелочами и др.; реакция с металлическим и перекисью начинается при 400°; , , и в этих условиях реагируют очень медленно; , , и некоторые др. в реакцию не вступают.
Перфторбензол и некоторые др. перфторароматическиеФ легко взаимодействуют с нуклеофильными реагентами, например с аммиаком, аминами, алкоголятами, сульфидом и др. При этом после замены одного замещается второй, находящийся в пара-положении к первому:
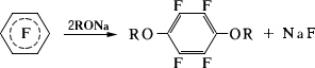
Пентафторхлорбензол образует магнийорганическое соединение 65, широко используемое в органическом синтезе.
Перфторолефины, в отличие от олефинов, являющихся нуклеофилами, резко электрофильны. Они легко реагируют с различными нуклеофилами (см. Нуклеофильные и электрофильные реагенты), причем в зависимости от типа последних образуются продукты присоединения или замещения в винильном (а) или аллильном (б) положении на остаток нуклеофила (Nu):
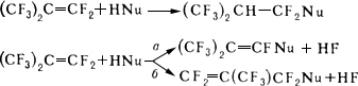
ЭлектрофильныеФ реагируют с значительно труднее, чем с их углеводородными аналогами. Однако присоединяют галогены, смешанные галогены, серный ангидрид и др. сильные электрофильные реагенты. Перфторолефины легко вступают в радикальные реакции, например
2 = 2 + 24 ® 22 — 22 + 22 — 2,
легко полимеризуются и сополимеризуются (см. Фторопласты, Фторкаучуки). При окислении j-олефинов в щелочной среде образуются j-окиси (см. ниже).
Монофторметанол — нестойкая жидкость, tkип 51°; ди- и трифторметанолы не получены, но известны производные трифторметанола: трифторметилгипофторит 3 — газ, tkип — 95°, и алкоголяты 3 и 3. спирты (b-, g-, но не a-) — устойчивые, легко перегоняющиеся жидкости. Кислотные свойства спиртов усиливаются по мере накопления
С увеличением содержания в молекулах альдегидов и кетонов электрофильность карбонильного резко усиливается. Перфторальдегиды и перфторкетоны, подобно образуют стойкие геминальные диолы, например 3— ()2, 3— ()2—3, и полуацетали; легче, чем их углеводородные аналоги, присоединяют 3, , 2 и др. нуклеофильные реагенты; легко подвергаются распаду с образованием например:
33 + ® 3 + 3.
Частично кетоны и альдегиды характеризуются высоким содержанием енольных форм (см. Таутомерия), склонных к образованию внутрикомплексных соединений; это свойство их используется для разделения редких и рассеянных элементов, например с помощью теноилтрифторацетона выделяют и очищают , Со, , , Ас, а также радиоактивные изотопы, образующиеся в ядерном реакторе.
карбоновые кислоты сильнее незамещенных и соответствующих кислот. Однако n- кислота слабее вследствие большей способности к сопряжению.
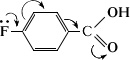
Под влиянием третичных аминов или ионов j-окиси легко изомеризуются, а также полимеризуются, образуя исключительно стойкие к действию агрессивных сред масла.
Первичные и вторичные перфторалкиламины типа 32 и (3)2 малоустойчивы, третичные — исключительно стойки к действию самых агрессивных сред; они лишены основных свойств вследствие сильного снижения электронной плотности на
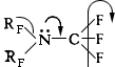
Разнообразные органическиеФ, несущие группы — 2, являются сильными окислителями.
типа R = устойчивы; в отличие от аналогов, окрашены в интенсивно-синий цвет, например трифторнитрозометан — синий газ, tkип — 84°. При сополимеризации последнего с тетрафторэтиленом получается один из наиболее стойких т. н. нитрозокаучук.
Из Ф, содержащих серу, известны, например, сульфиды, ди- и полисульфиды, сульфоокиси, сульфоны, сульфоновые кислоты и их производные; промышленное применение нашли перфторсульфокислоты, в частности трифторметансульфокислота, и дифтортиофосген 2 (в синтезе эластомеров).
Из соединений металлов и металлоидов наибольшее значение имеютФ с , , , ; сравнительно хорошо изученыФ с Р, , . Перфтордиметилртуть (3)2 резко отличается от обычных соединений. Это бесцветное вещество, tпл 161°, хорошо растворимо в воде; в отличие от (3)2, практически не алкилирует. Диперфторвинилртуть — хороший перфторвинилирующий агент. Из соединений наибольшее значение имеет 3222((3), применяемый для производства термостойкого эластомера (см. Кремнийорганические каучуки).
Применение. Ф широко применяются во всех областях техники с ее экстремальными условиями эксплуатации. Ф используют для получения превосходящих благородные металлы по устойчивости к действию агрессивных сред; термостойких антикоррозионных покрытий; как негорючие, термостойкие и неокисляющиеся смазочные масла и гидравлические жидкости; поверхностно-активные и пламягасящие вещества, пропелленты и хладагенты (см. Фреоны). Трифторуксусная кислота и ее ангидрид применяются как промоторы этерификации; трифторнадуксусная кислота — специфический и удобный окислитель. В медицине Ф применяют как лекарственные препараты и средства для наркоза (см. Фторотан), как материалы для изготовления искусственных кровеносных сосудов, клапанов для сердца. Кроме того, на примере Ф изучены фундаментальные вопросы теории: природа связи, вандерваальсовы силы, механизмы реакций и др.
Лит.: Кнунянц И. Л., Фокин А. В., Покорение неприступного элемента, М., 1963; Кнунянц И. Л., Сокольский Г. А., Электрохимическое в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957; Шеппард У., Шартс К., органическая пер. с англ., М., 1972; Успехи химии пер. с англ., т. 1—4, Л., 1964—70; Fluorine chemistry reviews, ed. . Tarrant, v. 1—7, . . — (a. o.), 1967—74; Chambers R. D., Fluorine in organic chemistry, . . — (a. o.), 1973.
И. Л. Кнунянц.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:42:02
|

|

|
 |
|

|
 |
 |
 |
|