
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Термохимия | Термохимия (далее Т) раздел физической химии вообще и термодинамики химической в частности, включающий измерение и вычисление тепловых эффектов реакций, теплот фазовых переходов (например, парообразования), теплот др. процессов, изучение теплоемкостей, энтальпий и энтропий веществ и физико- систем, а также температурной зависимости этих величин.
Экспериментальный метод Т - калориметрия. Ее содержание составляет разработка методов определения перечисленных характеристик. Для термохимических измерений служат калориметры.
На необходимость исследования тепловых эффектов и теплоемкостей впервые (1752-54) указал М. В. Ломоносов. Первые термохимические измерения провели во 2-й половине 18 в. Дж. Блэк, А. Лавуазье и П. Лаплас. В 19 в. в работах Г. И. Гесса, П. Бертло, Х. Ю. Томсена, В. Ф. Лугинина и других ученых техника калориметрических измерений была усовершенствована. В начале 20 в. развитие Т ознаменовалось, с одной стороны, дальнейшим повышением точности и расширением интервала температур эксперимента, а с другой - установлением связи между энергетическими эффектами процессов и строением частиц ( молекул, ионов), а также положением элементов в периодической системе элементов Д. И. Вместе с тем росло число изученных веществ, а с середины 20 в. теория Т стала развиваться на основе квантовохимических и статистических представлений.
Трудность, а иногда и невозможность непосредственного измерения тепловых эффектов многих процессов часто приводит к необходимости их определения косвенным путем - к вычислению с помощью основного закона Т - Гесса закона. При этом для расчетов пользуются стандартными теплотами образования 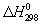 различных веществ, а для взаимодействия органических соединений - стандартными теплотами сгорания. Пересчет различных веществ, а для взаимодействия органических соединений - стандартными теплотами сгорания. Пересчет 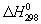 химических реакций на другие температуры осуществляют с помощью Кирхгофа уравнения. Отсутствие нужных для вычисления данных часто заставляет прибегать к приближенным закономерностям, позволяющим найти различные энергетические характеристики процессов и веществ на основании их состава и строения, а также по аналогии с изученными веществами и процессами. химических реакций на другие температуры осуществляют с помощью Кирхгофа уравнения. Отсутствие нужных для вычисления данных часто заставляет прибегать к приближенным закономерностям, позволяющим найти различные энергетические характеристики процессов и веществ на основании их состава и строения, а также по аналогии с изученными веществами и процессами.
Данные термохимические исследований и найденные закономерности используются для составления тепловых балансов технологических процессов, изучения теплотворности топлив, расчета равновесий химических, установления связи между энергетическими характеристиками веществ и их составом, строением, устойчивостью и реакционной способностью. В сочетании с др. термодинамическими характеристиками термохимические данные позволяют выбрать оптимальные режимы производств.
Широкое развитие получила Т растворов - определение теплоемкости, теплот растворения, смешения и испарения, а также их зависимости от температуры и концентрации. Эти характеристики позволяют установить свойства отдельных компонентов, рассчитать теплоты сольватации и тепловые эффекты др. процессов, что важно для суждения о природе растворов и их структуре. Методы Т используются в коллоидной химии, при изучении биологических процессов, во многих других исследованиях.
Лит.: Скуратов С. М., Колесов В. П., Воробьев А. Ф., Т, ч. 1-2, М., 1964-66; Мищенко К. П., Полторацкий Г. М., Вопросы термодинамики и строения водных и неводных растворов электролитов, (Л.), 1968; Experimental thermochemistry, v. 1-2, . .-L., 1956-62; Кальве Э., Пратт А., Микрокалориметрия, пер. с франц., М., 1963; Мортимер К., Теплоты реакций и прочность связей, пер. с англ., М., 1964; Бенсон С., Термохимическая кинетика, пер. с англ., М., 1971; Сталл Д., Вестрам Э., Зинке Г., термодинамика органических соединений, пер. с англ., М., 1971. См. также лит. при ст. Теплоемкость, Теплота образования, Термодинамика химическая.
М. Х. Карапетьянц. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:58:53
|

|

|
 |
|

|
 |
 |
 |
|