
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Сурьма | (далее С)(лат. Stibium), , элемент группы периодической системы номер 51, масса 121,75; металл цвета с синеватым оттенком. В природе известны два стабильных изотопа 121 (57,25% ) и 123 (42,75% ). Из искусственно полученных радиоактивных изотопов важнейшие 122 (Т1/2 = 2,8 cym), 124 (T1/2 = 60,2 cym) и 125 (T1/2 = 2 года).
Историческая справка. С известна с глубокой древности. В странах Востока она употреблялась примерно за 3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в 19 в. до н. э. порошок блеска (природный 23) под названием mesten или stem применялся для чернения бровей. В Древней Греции он был известен как stími и stíbi, отсюда латинский stibium. Около 12-14 вв. н. э. появилось название antimonium. В 1789 А. Лавуазье включил С в список элементов под названием antimoine (современный английский antimony, испанский и итальянский antimonio, немецкий Antimon). Русская "сурьма" произошло от турецкого sürme; им обозначался порошок блеска , также служивший для чернения бровей (по другим данным, "сурьма" - от персидского сурме - металл). Подробное описание свойств и способов получения С и ее соединений впервые дано алхимиком Василием Валентином ( в 1604.
Распространение в природе. Среднее содержание С в земной коре (кларк) 5 ×10–5 % по массе. В магме и биосфере С рассеяна. Из горячих подземных вод она концентрируется в гидротермальных месторождениях. Известны собственно месторождения, а также href="http://Hg-Mercury.info/" title="Mercury">ртутные, href="http://Pb-Lead.info/" title="Lead">свинцовые, href="http://W-Tungsten.info/" title="Tungsten">вольфрамовые. Из 27 минералов С главное промышленное значение имеет антимонит (23) (см. также Сурьмяные руды). Благодаря сродству с серой С в виде примеси часто встречается в сульфидах и других элементов.
Физические и свойства. С известна в и трех аморфных формах (взрывчатая, черная и желтая). Взрывчатая С (плотность 5,64-5,97 г/см3) взрывается при любом соприкосновении: образуется при электролизе раствора 3; черная (плотность 5,3 г/см3) - при быстром охлаждении паров С желтая - при пропускании в сжиженный 3. Желтая и черная С неустойчивы, при пониженных температурах переходят в обыкновенную С Наиболее устойчивая С (см. также Сурьма самородная), в тригональной системе, а = 4,5064 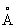 ; плотность 6,61-6,73 г/см3 (жидкой - 6,55 г/см3); tпл 630,5 °С; tкип 1635-1645 °С; удельная теплоемкость при 20-100 °С 0,210 кдж/(кг × К) (0,0498 кал/(г ×°С)); теплопроводность при 20 °С 17,6 вт/м × К (0,042 кал/(см × сек × °С)). Температурный коэффициент линейного расширения для поликристаллической С 11,5 ×10–6 при 0-100 °С; для монокристалла a1 = 8,1×10–6 a2 = 19,5×10–6 при 0-400 °С, удельное электросопротивление (20 °С) (43,045×10–6 ом×см). С диамагнитна, удельная восприимчивость -0,66 ×10–6. В отличие от большинства металлов, С хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддается ковке (иногда ее относят к полуметаллам). Механические свойства зависят от чистоты металла. Твердость по Бринеллю для литого металла 325-340 Мн/м2 (32,5-34,0 кгс/мм2); модуль упругости 285-300; предел прочности 86,0 Мн/м2 (8,6 кгс/мм2). Конфигурация внешних электронов Sb5s25r3. В соединениях проявляет степени окисления главным образом +5, +3 и –3. ; плотность 6,61-6,73 г/см3 (жидкой - 6,55 г/см3); tпл 630,5 °С; tкип 1635-1645 °С; удельная теплоемкость при 20-100 °С 0,210 кдж/(кг × К) (0,0498 кал/(г ×°С)); теплопроводность при 20 °С 17,6 вт/м × К (0,042 кал/(см × сек × °С)). Температурный коэффициент линейного расширения для поликристаллической С 11,5 ×10–6 при 0-100 °С; для монокристалла a1 = 8,1×10–6 a2 = 19,5×10–6 при 0-400 °С, удельное электросопротивление (20 °С) (43,045×10–6 ом×см). С диамагнитна, удельная восприимчивость -0,66 ×10–6. В отличие от большинства металлов, С хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддается ковке (иногда ее относят к полуметаллам). Механические свойства зависят от чистоты металла. Твердость по Бринеллю для литого металла 325-340 Мн/м2 (32,5-34,0 кгс/мм2); модуль упругости 285-300; предел прочности 86,0 Мн/м2 (8,6 кгс/мм2). Конфигурация внешних электронов Sb5s25r3. В соединениях проявляет степени окисления главным образом +5, +3 и –3.
В отношении С малоактивна. На воздухе не окисляется вплоть до температуры плавления. С и не реагирует. незначительно растворяется в расплавленной С Металл активно взаимодействует с и др. галогенами, образуя сурьмы галогениды. С взаимодействует при температуре выше 630 °С с образованием 23(см. Сурьмы окислы). При сплавлении с серой получаются сурьмы сульфиды, так же взаимодействует с и С устойчива по отношению к воде и разбавленным кислотам. Концентрированные соляная и серная кислоты медленно растворяют С с образованием 3 и сульфата 2(4)3; концентрированная кислота окисляет С до высшего окисла, образующегося в виде гидратированного соединения xSb25 ×уН2О. Практический интерес представляют труднорастворимые соли кислоты - антимонаты(Ме3 ×32, где Me - , К) и соли не выделенной метасурьмянистой кислоты - метаантимониты (MeSbO2 ×ЗН2О), обладающие восстановительными свойствами. С соединяется с металлами, образуя антимониды.
Получение. С получают пирометаллургической и гидрометаллургической переработкой концентратов или руды, содержащей 20-60% . К пирометаллургическим методам относятся осадительная и восстановительная плавки. Сырьем для осадительной плавки служат сульфидные концентраты; процесс основан на вытеснении С из ее сульфида 23 + 3 Û 2 + 3. вводится в шихту в виде скрапа. Плавку ведут в отражательных или в коротких вращающихся барабанных печах при 1300-1400 °С Извлечение С в черновой металл составляет более 90%. Восстановительная плавка С основана на восстановлении ее окислов до металла древесным углем или каменноугольной пылью и ошлаковании пустой породы. Восстановительной плавке предшествует окислительный обжиг при 550 °С с избытком воздуха. Огарок содержит нелетучую четырехокись С Как для осадительной, так и для восстановительной плавок возможно применение электропечей. Гидрометаллургический способ получения С состоит из двух стадий: обработки сырья щелочным сульфидным раствором с переводом С в раствор в виде солей кислот и сульфосолей и выделения С электролизом. Черновая С в зависимости от состава сырья и способа ее получения содержит от 1,5 до 15% примесей: , , и др. Для получения чистой С применяют пирометаллургическое или электролитическое рафинирование. При пирометаллургическом рафинировании примеси и меди удаляют в виде сернистых соединений, вводя в расплав С антимонит (крудум) - 23, после чего удаляют (в виде арсената и серу при продувке воздуха под содовым шлаком. При электролитическом рафинировании с растворимым анодом черновую С очищают от меди и др. металлов, остающихся в электролите (Си, , Аи остаются в шламе). Электролитом служит раствор, состоящий из 3, 24 и . Содержание примесей в рафинированной С не превышает 0,5-0,8%. Для получения С высокой чистоты применяют зонную плавку в атмосфере инертного газа или получают С из предварительно очищенных соединений - трехокиси или трихлорида.
Применение. С применяется в основном в виде сплавов на основе и для аккумуляторных пластин, кабельных оболочек, подшипников (баббит), сплавов, применяемых в полиграфии (гарт), и т. д. Такие сплавы обладают повышенной твердостью, износоустойчивостью, коррозионной стойкостью. В люминесцентных лампах галофосфатом активируют . С входит в состав полупроводниковых материалов как легирующая добавка к и а также в состав антимонидов (например, ). Радиоактивный изотоп 12 применяется в источниках g-излучения и нейтронов.
О. Е. Крейн.
в организме. Содержание С (на 100 г сухого вещества) составляет в растениях 0,006 мг, в морских животных 0,02 мг, в наземных животных 0,0006 мг. В организм животных и человека С поступает через органы дыхания или желудочно-кишечный тракт. Выделяется главным образом с фекалиями, в незначительном количестве - с мочой. Биологическая роль С неизвестна. Она избирательно концентрируется в щитовидной печени, селезенке. В эритроцитах накапливается преимущественно С в степени окисления + 3, в плазме крови - в степени окисления + 5. Предельно допустимая концентрация С 10–5 - 10–7 г на 100 г сухой ткани. При более высокой концентрации этот элемент инактивирует ряд ферментов липидного, углеводного и обмена (возможно в результате блокирования сульфгидрильных групп).
В медицинской практике препараты С (солюсурьмин и др.) используют в основном для лечения лейшманиоза и некоторых гельминтозов (например, шистосоматоза).
С и ее соединения ядовиты. Отравления возможны при выплавке концентрата руд и в производстве сплавов С При острых отравлениях - раздражение слизистых оболочек верхних дыхательных путей, глаз, а также кожи. Могут развиться дерматит, конъюнктивит и т. д. Лечение: антидоты (унитиол), мочегонные и потогонные средства и др. Профилактика: механизация производств. процессов, эффективная вентиляция и т. д.
Лит.: Шиянов А. Г., Производство М., 1961; Основы металлургии, т. 5, М., 1968; Исследование в области создания новой технологии производства и ее соединений, в сборнике: и технология Фр., 1965. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 23.02.2026 13:08:20
|

|

|
 |
|

|
 |
 |
 |
|