
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Стронций | (далее С)(лат. Strontium), , элемент группы периодической Системы номер 38, масса 87,62, металл. Природный С состоит из смеси четырех стабильных изотопов: 84, 86, 87 и 88; наиболее распространен 88 (82,56%).
Искусственно получены радиоактивные изотопы с массовыми числами от 80 до 97, в том числе 90 (Т 1/2 = 27,7 года), образующийся при делении В 1790 шотландский врач А. Крофорд, исследуя найденный близ населенного пункта Строншиан (в Шотландии) минерал, обнаружил, что он содержит неизвестную ранее "землю", которая была названа Позднее оказалось, что это окись С . В 1808 Г. Дэви, подвергая электролизу с катодом смесь увлажненной гидроокиси (ОН)2 с окисью получил амальгаму С
Распространение в природе. Среднее содержание С в земной коре (кларк) 3,4-102% по массе, в геохимических процессах он является спутником Известно около 30 минералов С важнейшие — целестин 4 и стронцианит 3. В магматических породах С находится преимущественно в рассеянном виде и входит в виде изоморфной примеси в решетку и минералов. В биосфере С накапливается в карбонатных породах и особенно в осадках соленых озер и лагун (месторождения целестина).
Физические и свойства. При комнатной температуре решетка С кубическая гранецентрированная (a-) с периодом а = 6,0848 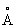 ; при температуре выше 248 °С превращается в гексагональную модификацию (b-) с периодами решетки а=4,32 ; при температуре выше 248 °С превращается в гексагональную модификацию (b-) с периодами решетки а=4,32 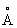 и с = 7,06 и с = 7,06 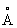 ; при 614 °С переходит в кубическую объемноцентрированную модификацию (g-) с периодом а = 4,85 ; при 614 °С переходит в кубическую объемноцентрированную модификацию (g-) с периодом а = 4,85 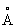 . радиус 2,15 . радиус 2,15 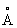 , ионный радиус 2 + 1,20 , ионный радиус 2 + 1,20 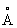 . Плотность a - формы 2,63г/см3 (20 °С); tпл 770 °С, tkип 1383 °С; удельная теплоемкость 737,4 кдж/(кг·К) (0,176 кал/(г·°С)); удельное электросопротивление 22.76-10-6ом·см3 С парамагнитен, восприимчивость при комнатной температуре 91,2·10-6. С — мягкий пластичный металл, легко режется ножом. Конфигурация внешней электронной оболочки 5s2, в соединениях обычно имеет степень окисления +2. С — щелочноземельный металл, по свойствам сходен с и . Металлический С быстро окисляется на воздухе, образуя желтоватую поверхностную пленку, содержащую окись , перекись 2 и нитрид 32. С при обычных условиях образует окись (серовато-белый порошок), которая на воздухе легко переходит в карбонат 3: с водой энергично взаимодействует, образуя гидроокись ()2 — основание более сильное, чем ()2. При нагревании на воздухе легко воспламеняется, а порошкообразный С на воздухе самовозгорается, поэтому хранят С в герметически закрытых сосудах под слоем керосина. Бурно разлагает воду с выделением и образованием гидроокиси. При повышенных температурах взаимодействует с (>200 °С), (>400 °С), серой и галогенами. При нагревании образует интерметаллические соединения с металлами, например 3, 4, 8, 12. Из солей С хорошо растворимы в воде галогениды (кроме нитрат, ацетат, трудно растворимы карбонат, сульфат, оксалат и фосфат. Осаждение С в виде оксалата и сульфата используют для его аналитического определения. Многие соли С образуют содержащие от 1 до 6 молекул воды. Сульфид постепенно гидролизуется водой: нитрид 32 (черные легко разлагается водой с выделением 3 и ()2. С хорошо растворяется в жидком аммиаке, давая растворы темно-синего цвета. . Плотность a - формы 2,63г/см3 (20 °С); tпл 770 °С, tkип 1383 °С; удельная теплоемкость 737,4 кдж/(кг·К) (0,176 кал/(г·°С)); удельное электросопротивление 22.76-10-6ом·см3 С парамагнитен, восприимчивость при комнатной температуре 91,2·10-6. С — мягкий пластичный металл, легко режется ножом. Конфигурация внешней электронной оболочки 5s2, в соединениях обычно имеет степень окисления +2. С — щелочноземельный металл, по свойствам сходен с и . Металлический С быстро окисляется на воздухе, образуя желтоватую поверхностную пленку, содержащую окись , перекись 2 и нитрид 32. С при обычных условиях образует окись (серовато-белый порошок), которая на воздухе легко переходит в карбонат 3: с водой энергично взаимодействует, образуя гидроокись ()2 — основание более сильное, чем ()2. При нагревании на воздухе легко воспламеняется, а порошкообразный С на воздухе самовозгорается, поэтому хранят С в герметически закрытых сосудах под слоем керосина. Бурно разлагает воду с выделением и образованием гидроокиси. При повышенных температурах взаимодействует с (>200 °С), (>400 °С), серой и галогенами. При нагревании образует интерметаллические соединения с металлами, например 3, 4, 8, 12. Из солей С хорошо растворимы в воде галогениды (кроме нитрат, ацетат, трудно растворимы карбонат, сульфат, оксалат и фосфат. Осаждение С в виде оксалата и сульфата используют для его аналитического определения. Многие соли С образуют содержащие от 1 до 6 молекул воды. Сульфид постепенно гидролизуется водой: нитрид 32 (черные легко разлагается водой с выделением 3 и ()2. С хорошо растворяется в жидком аммиаке, давая растворы темно-синего цвета.
Получение и применение. Основным сырьем для получения соединений С служат концентраты от обогащения целестина и Металлический С получают восстановлением окиси С при 1100—1150 °С:
4 + 2AI = 3 + ·23.
Процесс ведут в электровакуумных аппаратах (при 1 н/м2 (10 -2 мм рт. ст.)) периодического действия. Пары С конденсируются на охлажденной поверхности вставленного в аппарат конденсатора; по окончании восстановления аппарат заполняют и расплавляют конденсат, который стекает в изложницу. С получают также электролизом расплава, содержащего 85% 2 и 15% , однако при этом процессе выход по току невелик, а металл оказывается загрязненным солями, нитридом и окисью. В промышленности электролизом с жидким катодом получают сплавы С например с
Практическое применение металлического С невелико. Он служит для раскисления меди и бронзы. -90 — источник b-излучения в электрических батареях. С используется для изготовления люминофоров и фотоэлементов, а также сильно пирофорных сплавов. Окись С входит в состав некоторых оптических стекол и оксидных катодов электронных ламп. Соединения С окрашивают пламя в интенсивный вишнево-красный цвет, благодаря чему некоторые из них находят применение в пиротехнике. вводят в шлак для очистки высокосортных сталей от серы и карбонат С используют в неиспаряющихся геттерах, а также добавляют в состав стойких к атмосферным воздействиям глазурей и эмалей для покрытия фарфора, сталей и жаропрочных сплавов. 4 — очень устойчивый пигмент для изготовления художественных красок, 3 применяют как сегнетоэлектрик, он входит в состав пьезокерамики. соли жирных кислот ("стронциевые мыла") используют для изготовления специальных консистентных смазок.
Соли и соединения С малотоксичны; при работе с ними следует руководствоваться правилами техники безопасности с солями щелочных и щелочноземельных металлов. См. также разделы в организме и
М. Е. Ерлыкина.
в организме. С — составная часть микроорганизмов, растений и животных. У морских радиолярий (акантарий) скелет состоит из сульфата С — целестина. Морские водоросли содержат 26—140 мг С на 100 г сухого вещества, наземные растения — 2,6, морские животные — 2—50, наземные животные — 1,4, бактерии — 0,27—30. Накопление С различными организмами зависит не только от их вида, особенностей, но и от соотношения в среде С с др. элементами, главным образом с и Р, а также от адаптации организмов к определенной геохимической среде.
Животные получают С с водой и пищей. Всасывается С тонким, а выделяется в основном толстым кишечником. Ряд веществ (полисахариды водорослей, катионообменные смолы) препятствует усвоению С Главное депо С в организме — костная ткань, в золе которой содержится около 0,02% С (в др. тканях — около 0,0005%). Избыток солей С в рационе крыс вызывает "стронциевый" рахит. У животных, обитающих на почвах со значительным количеством целестина, наблюдается повышенное содержание С в организме, что приводит к ломкости костей, рахиту и др. заболеваниям. В биогеохимических провинциях, богатых С (ряд районов Центральной и Восточной Азии, Северной Европы и др.), возможна т. н. уровская болезнь.
Г. Г. Поликарпов.
Среди искусственных изотопов С его долгоживущий радионуклид 90 — один из важных компонентов радиоактивного загрязнения биосферы. Попадая в окружающую среду, 90 характеризуется способностью включаться (главным образом вместе с ) в процессы обмена веществ у растений, животных и человека. Поэтому при оценке загрязнения биосферы 90 принято рассчитывать отношение 90/ в единицах (1 с. е. = 1 мк мккюри 90 на 1 г ). При передвижении 90 и по биологическим и пищевым цепям происходит дискриминация С для количественного выражения которой находят "коэффициент дискриминации", отношение 90/ в последующем звене биологической или пищевой цепи к этой же величине в предыдущем звене. В конечном звене пищевой цепи концентрация 90, как правило, значительно меньше, чем в начальном.
В растения 90 может поступать непосредственно при прямом загрязнении листьев или из почвы через корни (при этом большое влияние имеет тип почвы, се влажность, pH, содержание и органических веществ и т.д.). Относительно больше накапливают 90 бобовые растения, корне- и клубнеплоды, меньше — злаки, в том числе зерновые, и лен. В семенах и плодах накапливается значительно меньше 90, чем в др. органах (например, в листьях и стеблях пшеницы 90 в 10 раз больше, чем в зерне). У животных (поступает в основном с растительной пищей) и человека (поступает в основном с коровьим молоком и рыбой) 90 накапливается главным образом в костях. Величина отложения 90 в организме животных и человека зависит от возраста особи, количества поступающего радионуклида, интенсивности роста новой костной ткани и др. Большую опасность 90 представляет для детей, в организм которых он поступает с молоком и накапливается в быстро растущей костной ткани.
Биологическое действие 90 связано с характером его распределения в организме (накопление в скелете) и зависит от дозы b-облучения, создаваемого им и его дочерним радиоизотопом 90. При длительном поступлении 90 в организм даже в относительно небольших количествах, в результате непрерывного облучения костной ткани, могут развиваться лейкемия и рак костей. Существенные изменения в костной ткани наблюдаются при содержании "° в рационе около 1 мккюри на 1 г . Заключение в 1963 в Москве Договора о запрещении испытаний ядерного оружия в атмосфере, космосе и под водой привело к почти полному освобождению атмосферы от 90 и уменьшению его подвижных форм в почве.
В. А. Кальченко.
Лит.: Бурков В. В., Подпоряна Е. К., М., 1962; Булдаков Л. А. и Москалев Ю. И., Проблемы распределения и экспериментальной оценки допустимых уровней 137, 90 и 106, М., 1968; Юдинцева Е. В., Гулякин И. В., Агрохимия радиоактивных изотопов и М., 1968; Метаболизм Сб. статей, пер. с англ., М., 1971; Радиоактивность и пища человека, пер. с англ., М., 1971; Ковальский В. В., Геохимическая экология, М., 1974; Хеморадиоэкология пелагиали и бентали, К., 1974; Bowen Н. J. М., Trace elemetns in biochemistry, L. — . ., 1966.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 21:02:17
|

|

|
 |
|

|
 |
 |
 |
|