
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Ртуть | (далее Р)(лат. Hydrargyrum), , элемент группы периодической системы номер 80, масса 200,59; тяжелый металл, жидкий при комнатной температуре. В природе Р представлена семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%).
Историческая справка. Самородная Р была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась киноварь (природная ) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н. э.), нагревая киноварь в сосуде с крышкой, получил Р в виде паров, которые конденсировались на холодной внутренней поверхности крышки. Продукт реакции был назван hydrárgyros (от греч. hýdor - вода и árgyros - т. е. жидким откуда произошли латинские названия hydrargyrum, а также argentum vivum - живое Последнее сохранилось в названиях . quicksilver (англ.) и Quecksilber (нем.). Происхождение русского названия Р не установлено. Алхимики считали Р главной составной частью всех металлов. "Фиксация" Р (переход в твердое состояние) признавалась первым условием ее превращения в Твердую Р впервые получили в декабре 1759 петербургские академик И. А. Браун и М. В. Ломоносов. Ученым удалось заморозить Р в смеси из снега и концентрированной кислоты. В опытах Ломоносова отвердевшая Р оказалась ковкой, как Известие о "фиксации" Р произвело сенсацию в ученом мире того времени; оно явилось одним из наиболее убедительных доказательств того, что Р - такой же металл, как и все прочие.
Распространение Р в природе. Р принадлежит к числу весьма редких элементов, ее среднее содержание в земной коре (кларк) близко к 4,5×10-6% по массе. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии Р играет ее миграция в газообразном состоянии и в водных растворах. В земной коре Р преимущественно рассеяна; осаждается из горячих подземных вод, образуя ртутные руды (содержание Р в них составляет несколько процентов). Известно 35 минералов; главнейший из них - киноварь .
В биосфере Р в основном рассеивается и лишь в незначительных количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4×10-5%). В морской воде содержится 3×10-9% Р
Самородная Р встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путем (выделяется из водных растворов).
Физические и свойства Р - единственный металл, жидкий при комнатной температуре. Твердая Р в ромбические сингонии, а = 3,463 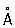 , с = 6,706 , с = 6,706 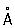 ; плотность твердой Р 14,193 г/см3 (-38,9 °С), жидкой 13,52 г/см3 (20 °С), радиус 1,57 ; плотность твердой Р 14,193 г/см3 (-38,9 °С), жидкой 13,52 г/см3 (20 °С), радиус 1,57 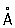 , ионный радиус 2+ 1,10 , ионный радиус 2+ 1,10 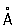 ; tпл - 38,89 °С; tkип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/(кг ×К) (0,03336 кал/(г×°С)); при 200 °С 0,133 кдж/(кг×К)(0,0319 кал/(г ×°С)); температурный коэффициент линейного расширения 1,826×10-4 (0-100 °С); теплопроводность 8,247вт/(м×К) (0,0197 кал/(см×сек×°) (при 20°); удельное электросопротивление при 0°С 94,07×10-8 ом×м (94,07×10-6 ом×см). При 4,155 К Р становится сверхпроводником (см. Сверхпроводимость). Р диамагнитна, ее восприимчивость равна -0,19×10-6 (при 18 °С). ; tпл - 38,89 °С; tkип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/(кг ×К) (0,03336 кал/(г×°С)); при 200 °С 0,133 кдж/(кг×К)(0,0319 кал/(г ×°С)); температурный коэффициент линейного расширения 1,826×10-4 (0-100 °С); теплопроводность 8,247вт/(м×К) (0,0197 кал/(см×сек×°) (при 20°); удельное электросопротивление при 0°С 94,07×10-8 ом×м (94,07×10-6 ом×см). При 4,155 К Р становится сверхпроводником (см. Сверхпроводимость). Р диамагнитна, ее восприимчивость равна -0,19×10-6 (при 18 °С).
Конфигурация внешних электронов 5d 106s2, в соответствии с чем при реакциях образуются катионы 2+ и 22+. активность Р невелика. В сухом воздухе (или она при комнатной температуре сохраняет свой блеск неограниченно долго. С дает 2 соединения: черную закись 2 и красную окись . 2 появляется в виде черной пленки на поверхности Р при действии озона. образуется при нагревании на воздухе (300-350 °С), а также при осторожном нагревании нитратов (3)2 или 2(3)2. Гидроокись Р практически не образуется. При взаимодействии с металлами, которые Р смачивает, образуются амальгамы. Из сернистых соединений важнейшим является , которую получают растиранием с серным цветом при комнатной температуре, а также осаждением растворов солей 2+ сероводородом или сульфидом щелочного металла. С галогенами ( иодом) Р соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа HgX2. В соляной и разбавленной серной кислотах Р не растворяется но растворима в царской водке, и горячей концентрированной серной кислотах.
Почти все соли 2+ плохо растворимы в воде. К хорошо растворимым относится нитрат (3)2.
Большое значение имеют Р 22 (каломель) и 2 (сулема) Известны соли окисной Р цианистой и роданистой кислот, а также соль гремучей кислоты ()2, т. н. гремучая ртуть. При действии аммиака на соли образуются многочисленные комплексные соединения, например ×23 (плавкий белый преципитат) и 2 (неплавкий белый преципитат). Применение находят ртутьорганические соединения.
Получение Р руды (или рудные концентраты), содержащие Р в виде киновари, подвергают окислительному обжигу
+ 2 = + 2.
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая Р стекает в приемники. Для очистки сырую Р пропускают тонкой струйкой через высокий (1-1,5м) сосуд с 10%-ной 3, промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение Р из руд и концентратов растворением в сернистом с последующим вытеснением Р Разработаны способы извлечения Р электролизом сульфидных растворов.
Применение. Р широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, капиллярные электрометры и др.), в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации и при изготовлении взрывчатых веществ (см. Гремучая ртуть); в медицине (каломель, сулема, и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения Р в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Р и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
С. А. Погодин.
Р в организме. Содержание Р в организмах составляет около 10-6% В среднем в организм человека с пищей ежесуточно поступает 0,02-0,05 мг Р Концентрация Р в крови человека составляет в среднем 0,023 мкг/мл, в моче - 0,1-0,2 мкг/мл. В связи с загрязнением воды промышленными отходами в теле многих ракообразных и рыб концентрация Р (главным образом в виде ее органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы Р и ее соединения, связываясь с сульфгидрильными группами ферментов, могут инактивировать их. Попадая в организм, Р влияет на поглощение и обмен микроэлементов - , , , . В целом биологическая роль Р в организме изучена недостаточно.
Ю. И. Раецкая.
Отравления Р и ее соединениями возможны на рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и др.
Основную опасность представляют пары металлической Р выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании Р попадает в кровь. В организме Р циркулирует в крови, соединяясь с частично откладывается в печени, в почках, селезенке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма Р выводится через почки, кишечник, потовые и др.
Острые отравления Р и ее парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления - появление по краю десен каймы сине-черного цвета; поражение десен (разрыхленность, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органическими соединениями Р (диэтилмеркурфосфатом, диэтил- этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефало-полиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Лечение: внутривенное введение 20%-ного раствора гипосульфита (12-15 вливаний на курс), унитиол, фармакологические и физиотерапевтические средства, нормализующие высшую нервную деятельность, курортолечение (Пятигорск, Мацеста и т. п.) и др. Профилактика: замена Р менее вредными веществами, правильные способы хранения, соблюдение мер безопасности при использовании (герметичность оборудования, рациональная отделка помещений, рабочих поверхностей, эффективная вентиляция), индивидуальная защита; предварительные и периодические медицинские осмотры.
Препараты Р находят применение в медицинской практике, главным образом благодаря их антисептическим и мочегонным свойствам. Как мочегонные применяют меркузал, промеран и др. В качестве антисептиков используют сулему (дезинфекция кожи, одежды, предметов ухода за больными и т. п.), диоцид (стерилизация хирургических инструментов и т. п.), цианид и оксицианид Р (для промываний и спринцеваний при некоторых воспалительных процессах), амидохлорид Р (в виде мази при заболеваниях кожи), окись Р желтую (в виде мази при заболеваниях глаз и кожи). Применявшиеся ранее для лечения сифилиса препараты Р в современной практике не используются.
А. А. Каспаров.
Лит.: Мельников С. М., в кн.: Краткая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Рипан Р Четяну И., Неорганическая пер. с рум., М., 1972; Некрасов Б. В., Основы общей химии, 2 изд., т. 2, М., 1969; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., (ч. 2), Л., 1971; Трахтенберг И. М., Хроническое воздействие на организм, К., 1969; Профессиональные болезни, 3 изд., М., 1973.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:45:32
|

|

|
 |
|

|
 |
 |
 |
|