
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Произведение растворимости | Произведение растворимости (далее П), произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита. Показатели степени для концентраций, входящих в П, равны коэффициенту при соответствующем ионе в уравнении диссоциации электролита. Для неидеальных растворов концентрации должны быть заменены на активности и полученное произведение называется произведением активностей. При данной температуре и в данном растворителе П для каждого электролита есть характерная постоянная величина.
Постоянство П выводится из действующих масс закона и представляет собой частную форму этого закона в приложении к равновесию твердый электролит Û его насыщенный раствор. При этом предполагается, что в растворе электролит находится в полностью диссоциированной форме. П наиболее точно измеряется методом эдс. Часто для измерения П используют также определение растворимости по электропроводности насыщенных растворов. Для многих соединений П установлено с достаточной для практических целей точностью. В таблицах П обычно приводятся при температуре 25 °С (иногда при 18 °С).
Из правила постоянства П следует, что если произведение концентраций ионов в растворе превышает величину П, то выпадает осадок; в противном случае осадок не образуется. Это следствие позволяет регулировать содержание ионов в растворе при использовании процессов осаждения, растворения, а также высаливания, имеющих большое значение в аналитической химии и химической технологии. Так, при увеличении концентрации одного из ионов путем введения в раствор нового электролита с одноименным катионом или анионом концентрация др. иона понижается за счет выпадения части труднорастворимого электролита в осадок. Понижение растворимости происходит обычно лишь до некоторого минимального значения, после чего может наблюдаться вновь повышение растворимости из-за образования комплексных ионов или увеличения ионной силы раствора. Повышения растворимости можно достигнуть, связывая один из ионов в растворе, так что образуется др. ион, который не дает малорастворимого соединения. Например, для перевода в раствор осадка СаСО3 ион 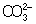 связывают с помощью иона Н+ в слабо диссоциированный ион связывают с помощью иона Н+ в слабо диссоциированный ион 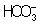 : : 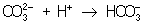 ; концентрация ионов ; концентрация ионов 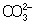 при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто П при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто П
Лит.: Справочник химика, 2 изд., т. 3, М. - Л., 1965; Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 2, М., 1973, гл. 18.
Н. Ф. Степанов.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 23.02.2026 17:01:41
|

|

|
 |
|

|
 |
 |
 |
|