
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Платиновые металлы | металлы (далее П) элементы второй и третьей триад группы периодической системы К ним принадлежат: (Ruthenium) , (Rhodium) , (Palladium) (легкие П, плотность ~12 г/см3); (Osmium) , (Iridium) lr, (Platinum) (тяжелые П, плотность ~22 г/см3). тугоплавкиеП; благодаря красивому внешнему виду и высокой стойкости П наряду с и называют благородными металлами.
Историческая справка. Имеются указания, что самородная в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп. конкистадоры обнаружили в Южной Америке вместе с самородным очень тяжелый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его — уменьшительным от исп. plata — В 1744 исп. морские офицер Антонио де Ульоа привез образцы в Лондон. Они вызвали живой интерес ученых Европы. Самостоятельным металлом , которую первоначально считали белым была признана в середине 18 в.
В 1803 английский ученый У. Х. Волластон обнаружил в самородной получивший это название от малой планеты Паллады (открытой в 1802), и названный так по розовато-красному цвету его солей (от греч. rhódon — роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной в царской водке открыл еще 2 металла. Один из них получил название вследствие разнообразия окраски его солей (от греч. íris, род. падеж íridos — радуга), другой был назван по резкому запаху его четырехокиси (от греч. osmá — запах). В 1844 К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной в Петербургском монетном дворе открыл еще один П — (от позднелат. Ruthenia — Россия).
С. А. Погодин.
Распространение в природе. П принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено, ориентировочные значения приведены в таблице. Самые редкие в земной коре — и lr (1×10-7% по массе), наиболее распространен (5×10-6%). Содержание П повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения П Еще выше среднее содержание П в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки П в каменных метеоритах составляют n×10-4 — n×10-5% по массе). Для земной коры характерно самородное состояние П, а у , , и известны также немногочисленные соединения с серой, и Установлено около 30 минералов П, больше всего их у (13) и (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях (см. Платиновые руды, Платина самородная). и другие П встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия П в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные руды обогащены (до 1×10-3%), в углях наблюдалась концентрация и (1×10-6%); повышенное содержание П отмечалось в (вятских), в золе деревьев, растущих на месторождениях .
А. И. Перельман.
Физические и свойства. Физические и механические свойства П сопоставлены в таблице. В дополнение необходимо указать, что и очень тверды и хрупки (возможно вследствие присутствия примесей). и lr обладают меньшими твердостью и хрупкостью, а и ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых П (, , ) поглощать Особенно это свойственно , объем которого поглощает до 900 объемов 2. При этом сохраняет металлический вид, но растрескивается и становится хрупким. Все П парамагнитны. восприимчивость cs×10-6 электро- единиц при 18 °С равна 0,05 у ; 0,50 у ; 5,4 у ; у , lr и она несколько более 1,0.
Согласно давно установившейся традиции, П принято помещать в группу периодической системы элементов. В соответствии с этим следовало ожидать, что все П должны иметь высшую степень окисления +8. Однако это наблюдается только у и , прочие же П проявляют валентность не выше +6. Объясняется это тем, что у и остаются незаполненными соответственно внутренние подуровни 4f и 5f. Поэтому для и возможно возбуждение не только с подуровней 5s и 6s на подуровни 5p и 6p, но и с подуровней 4d и 5d на подуровни 4f и 5f. Вследствие этого в и появляется по 8 непарных электронов и валентность +8. Электронные конфигурации , lr, , такой возможности не допускают. Поэтому в некоторых вариантах таблицы эти элементы (а также Со и ) выносят за пределы группы. Все П легко образуют комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения П, как правило, окрашены и очень прочны.
свойства П имеют много общего. Все они в компактном виде (кроме ) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) П легко адсорбируют , галогены и др. неметаллы. (Чернь обычно получают восстановлением П из водных растворов их соединений.) Компактные , , , lr, будучи сплавлены с , , , , переходят в раствор при действии царской водки, хотя она не действует на эти П, взятые отдельно.
Семейство П можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим легким и тяжелым П, а именно: , ; , lr; , .
При нагревании с 2 и сильными окислителями и образуют легкоплавкие — четырехокиси (тетроксиды) — оранжевую 4 и желтоватую 4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы 2 и 2 или вП. Со щелочами 4 образует рутенаты, например рутенат 2 по реакции:
4 + 2 = 24 + 1/22 + 2.
При действии 24 превращается в перрутенат
24 + 1/22 = 4 + .
Четырехокись 4 дает с комплексное соединение 2(4()2). С и др. галогенами и легко реагируют при нагревании, образуя соединения типа 3, 4, 5, 6. дает подобные же соединения, кроме 3; существование 8 не подтверждено. Весьма интересны комплексные соединения с ксеноном (6) (канадский химик Н. Бартлетт, 1962), а также с молекулярным — (()(3)4 2 (3)4 ) (советский химик Н. М. Синицын, 1962) и ( (3)52) 2 (канадский химик А. Аллен, 1965).
На компактные и lr царская водка не действует. При прокаливании в 2 образуются окислы 23 и 23, разлагающиеся при высоких температурах.
легко растворяется при нагревании в 3 и концентрированной 24 с образованием нитрата (3)2 и сульфата 4. На эти кислоты не действуют. Царская водка растворяет и , причем образуются комплексные кислоты — тетрахлоропалладиевая кислота 2(4) и гексахлороплатиновая — коричнево-красные состава 2(6)×62 Из ее солей наибольшее значение для технологии П имеет аммония (4)2(6) — светло-желтые малорастворимые в воде и почти не растворимые в концентрированных растворах 4. При прокаливании они разлагаются по реакции:
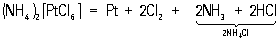
При этом получается в мелкораздробленном виде (т. н. губка, или губчатая
Получение. Разделение П и получение их в чистом виде очень сложно вследствие большого сходства их свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой исходные материалы — самородную шлихи (тяжелые остатки от промывки песков), лом (негодные для употребления изделия из и ее сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: , , частично , lr в виде комплексных соединений 2(6), 2(4), Нз (6) и 2(6), а также и в виде з и 2. Нерастворимый в царской водке остаток состоит из (2), кварца и др. минералов.
Из раствора осаждают в виде (4)2(6) аммонием. Но чтобы в осадок вместе с не выпал lr в виде аналогичного нерастворимого соединения (4)2(lrCl6) (остальные П 4 не осаждает), предварительно восстанавливают (+4) до (+3) (например, прибавлением 122211 по способу И. И. Черняева). Соединение (4)3(6) растворимо и не загрязняет осадка.
аммония отфильтровывают, промывают концентрированным раствором 4 (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую спрессовывают, а затем оплавляют в пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (4)2(6), и из извлекают прочие П путем сложных операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке П и используют спекание с перекисями 2 или 22. Применяют также — нагревание смеси -концентратов с и в струе
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (4)3(6), дихлорид тетрамминдиоксоосмия (2(3)4) 2, родия ( (3)5) 2, гексахлороиридат аммония (4)2(lrCl6) и дихлордиаммин ( (3)2) 2. Прокаливанием перечисленных соединений в атмосфере 2 получают П в виде губки, например
(2(3)4) 2 + 32 = + 22 + 43 + 2
( (3)2) 2 + 2 = + 23 + 2.
Губчатые П сплавляют в вакуумной электрической печи высокой частоты.
Применяют и др. способы аффинажа, в частности основанные на использовании ионитов.
Основным источником получения П служат сульфидные руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородныеП переходят в т. н. черновыеП — нечистые никель и медь. П собираются почти полностью в черновом , a и — в черновой . При последующем электролитическом рафинировании , и П осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Свойства металлов
Свойство
|
|
|
|
|
lr
|
|
номер
|
44
|
45
|
46
|
76
|
77
|
78
|
масса
|
101,07
|
102,9055
|
11906,4
|
190,2
|
192,22
|
195,09
|
Среднее содержание в земной коре, % по массе
|
(5·10-7)
|
1·10-7
|
1·10-6
|
5·10-6
|
1·10-7
|
5·10-7
|
Массовые числа природных изотопов (в скобках указано распространение
|
96, 98, 99, 100, 101,102 (31, 61), 104
|
103 (100)
|
102, 104, 105 (22,23), 106 (27,33), 108 (26,71), 110 (11,8)
|
184, 186, 187, 188, 189, 190 (26,4), 192 (41,0)
|
191 (38,5) 193 (61,5)
|
190, 192 (оба слабо радиоактивны), 194 (32,9), 196(25,2), 198 (7,19)
|
решетка, параметры в  (при 20 °С) (при 20 °С)
|
Гексагональ-
ная плотнейшей упаковки*
a =2,7057
c =4,2815
|
Гранецент-
рированная кубическая
a =3,7957
|
Гранецент-
рирован-
ная кубическая
a =3,8824
|
Гексаго-
нальная плотней-
шей упаковки
a =2,7533
c =4,3188
|
Гране-
центри-
рованная кубичес-
кая
a =3,8312
|
Гране-
центри-
рован-
ная кубичес-
кая
a =3,916
|
радиус, 
|
1,34
|
1,34
|
1,37
|
1,36
|
1,36
|
1,39
|
Ионный радиус,  (по Л. Полингу) (по Л. Полингу)
|
4+ 0,67
|
4+ 0,68
|
4+ 0,65
|
4+ 0,65
|
lr4+ 0,68
|
4+ 0,65
|
Конфигурация внешних электронных оболочек
|
4d75s1
|
4d85s1
|
4d10
|
5d66s2
|
5d76s2
|
5d96s1
|
Состояния окисления (наиболее характерные набраны полужирным шрифтом)
|
1,2,3,4,5,6,7,8
|
1,3,4
|
2,3,4
|
2,3,4,6,8
|
1,2,3,4,6
|
2,3,4
|
Плотность (при 20 °С), г/см3
|
12,2
|
12,42
|
11,97
|
22,5
|
22,4
|
21,45
|
Температура плавления, °С
|
2250
|
1960
|
1552
|
ок. 3050
|
2410
|
1769
|
Температура кипения, °С
|
ок. 4900
|
ок. 4500
|
ок. 3980
|
ок. 5500
|
ок. 5300
|
ок. 4530
|
Линейный коэффициент теплового расширения
|
9,1×10-6 (20°С)
|
8,5×10-6
(0—100 °С)
|
11,67×10-6 (0°С)
|
4,6×10-6°
|
6,5×10-6 (0—100°С)
|
8,9×10-6
(0°С)
|
Теплоемкость, кал/(г ×°С)
|
0,057 (0°)
|
0,059
(20 °)
|
0,058 (0°С)
|
0,0309 (°С)
|
0,0312
|
0,0314 (0°С)
|
кдж/(кг ×К.)
|
0,0312
|
0,247
|
0,243
|
0,129
|
0,131
|
0,131
|
Теплопроводность кал/(см ×сек °С)
|
—
|
0,36
|
0,17
|
—
|
—
|
0,17
|
вт/(м ×К)
|
—
|
151
|
71
|
—
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 14.02.2026 16:51:42
|

|

|
 |
|

|
 |
 |
 |
|
| |