
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Перекисные соединения | Перекисные соединения (далее П) класс соединений, содержащих непосредственно связанные между собой
П неорганические. Простейший, наиболее важный и распространенный представитель этой группы — перекись водорода 22. решетки неорганических П состоят из ионов металлов и из молекулярных анионов 22-, 2- и 3-. Соответственно по наличию этих групп различают перекиси, надперекиси и озониды. Все они являются различной силы окислителями, а при слабых термических или воздействиях разлагаются с выделением Наиболее просто — сжиганием на воздухе или в — получают перекиси и надперекиси щелочных металлов: 22, 22 (перекиси), 2, 2, 2 (надперекиси). Перекиси и надперекиси металлов — соли слабых кислот, соответственно перекиси 22 и пергидроксила 2. Сам пергидроксил — активная частица и при обычных температурах быстро превращается в 22 и 2.
Пергидроксил — промежуточная частица большинства процессов горения и окисления и перекисью Действием озона (3) на гидроокиси или надперекиси получают озониды щелочных металлов MO3 (например, 3). Термическая нестойкость, окислительная активность, количество способного выделиться растут в ряду перекиси — надперекиси — озониды. Гидролиз этих П происходит с образованием различных по силе окислителей (насыщенных соединений, как 22, или частиц, как ):
M22 + 22 = 2MOH + 22,
M22 + 2 = MOH + 2,
MO3 + 2 = MOH + + 2.
К этим группам соединений примыкают пероксигидраты — соединения, содержащие вместо воды 22, например 23.322, в том числе и пероксигидраты перекисей, например 2.222.
Пероксогруппа — — — входит в состав пероксо- или надкислот и двуядерных комплексных соединений. Примером служат пероксосерные кислоты — пероксомоно- и пероксодисерная,
2 — ООН
и
2 — — — 2.
Аналогичные пероксопроизводные известны для и некоторых других кислот. Эти соединения получают либо путем электролиза обычных кислот, либо при взаимодействии концентрированных кислот и 22. Двуядерные комплексы, содержащие пероксогруппу, известны для ряда металлов, а наиболее изучены для комплексов многие из них могут быть получены при взаимодействии с солями (в растворе или в состоянии). Большинство пероксосоединений водой гидролизуется с образованием 22.
П нашли применение в технике как окислители (пероксодисерная кислота, перекись натрия), отбеливатели (пероксобораты, например 3; пероксокар-бонаты, например 23), как удобные источники для регенерации воздуха — эквивалентного превращения 2 в 2 (надперекиси 2, 2). Некоторые комплексные пероксосоли обратимо присоединяют, а при нагревании или изменении кислотности раствора выделяют На этом основано их применение как "кислородных батарей", как переносчиков для разделения смесей. Различие в строении неорганических П обусловливает различие их физических свойств и реакционной способности и возможность применения в разнообразных условиях.
А. П. Пурмаль.
П органические содержат группировку — О — О —, связанную с одним или двумя Основные типы органических П: 1) перекиси алкилов и арилов R — — — R (здесь и далее R — алкил или арил); 2) перекиси ацилов RCO———COR; 3) гидроперекиси R — — — Н; 4) перкислоты (надкислоты) RCO — — — . К ним примыкают соединения, в которых перекисная группировка связана с гетероатомом, например R3 — — — , R2 — — OR, и озониды, содержащие группировки — О — О — О —, например 3 — — — — 3.
П получают главным образом окислением различных органических соединений (например, насыщенных углеводородов, олефинов, спиртов, альдегидов, кетонов, металлоорганических соединений) (часто — фотохимически) или перекисью например:
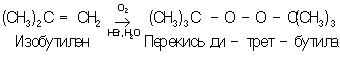
Перекиси ацилов и надкислоты получаются взаимодействием карбоновых кислот или их производных с перекисью в присутствии оснований:
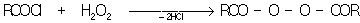 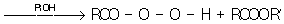
Перекись диметила 33 — газ, tкип — 13 °С; перекись ди-трет-бутила — tкип 70 °С (при 197 мм рт. ст.); перекись ацетила (3)2 — tпл 27 °С, tкип 63 °С (при 21 мм рт. ст.), перекись бензоила (65)2 — tпл 106—108 °С; надбензойная кислота 65 — — — — tпл 41—43 °. Известны полимерные П типа
.
При нагревании или облучении ультрафиолетовым светом органических П происходит разрыв связи с образованием свободных радикалов типа RO× или RCO — ×, дальнейшая судьба которых (а следовательно, и общее направление реакции) зависит от характера R. Алкоксильные или ацилоксильные радикалы чаще всего распадаются дальше, давая свободные углеводородные радикалы, например:
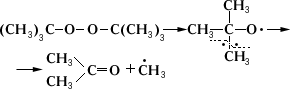
Образующиеся свободные радикалы могут вызвать цепной распад П, поэтому многие из них, особенно низшие, взрывчаты. Это необходимо учитывать при работе с олефинами, диенами и простыми эфирами, легко образующими П при действии воздуха. Стабильность П возрастает с увеличением электроотрицательности заместителей, связанных с перекисной группой, а также при переходе от первичных радикалов к вторичным и третичным.
Органические П (перекиси бензоила, ацетила, ди-трет-бутила) широко используют для инициирования свободнорадикальной полимеризации, вулканизации каучуков, а также таких реакций, как окисление, галогенирование, присоединение по двойным связям, теломеризация и др. П, особенно надкислоты, применяются в органическом синтезе как окислители, например для получения окисей олефинов (Прилежаева реакция), в текстильной промышленности — как отбеливающие вещества. П— промежуточные продукты многих промышленно важных реакций, например синтеза фенола и ацетона окислением кумола; они играют большую роль в процессах горения и окислительных биохимических процессах.
Б. Л. Дяткин.
Лит.: Вольнов И. И., Перекиси, надперекиси и озониды щелочных и щелочною земельных металлов, М., 1964; его же, Современные воззрения на природу неорганических перекисных соединений, "Успехи химии", 1972, т. 41, в. 4; Карножицкий В., Органические перекиси, пер. с франц., М., 1961. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 23.02.2026 16:54:14
|

|

|
 |
|

|
 |
 |
 |
|