
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Осмотическое давление | Осмотическое давление (далее О), диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворенного вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия - осмотическое всасывание растворителя через мембрану в раствор. В этом случае О становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии (см. Осмос). О обусловлено понижением химического потенциала растворителя в присутствии растворенного вещества. Тенденция системы выравнивать потенциалы во всех частях своего объема и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества. О в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворенных веществ; при постоянной температуре оно определяется только числом "кинетических элементов" - ионов, молекул, ассоциатов или коллоидных частиц - в единице объема раствора. Первые измерения О произвел В. Пфеффер (1877), исследуя водные растворы тростникового Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О от концентрации растворенного вещества, совпадающую по форме с Бойля - Мариотта законом для идеальных газов. Оказалось, что О (p) численно равно давлению, которое оказало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора. Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n - число молей растворенного вещества в объеме раствора ; R - универсальная газовая постоянная; Т - абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворенного вещества i < 1. О реального раствора (p") всегда выше, чем идеального (p"), причем отношение p"/ p" = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым О называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О, его называют гипертоническим, а имеющий более низкое О - гипотоническим.
О измеряют с помощью специальных приборов - осмометров. Различают статические и динамические методы измерения. Первый метод основан на определении избыточного гидростатического давления по высоте столба жидкости Н в трубке осмометров (рис.) после установления осмотического равновесия при равенстве внешних давлений pA и рБ в камерах А и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотической ячейки при различных значениях избыточного давления Dp = pA - рБ с последующей интерполяцией полученных данных к n = 0 при Dp = p. Многие осмометры позволяют использовать оба метода. Одна из главных трудностей в измерении О - правильный подбор полупроницаемых мембран. Обычно применяют пленки из целлофана, природных и синтетических полимеров, пористые керамические и стеклянные перегородки. Учение о методах и технике измерения О называются осмометрией. Основное приложение осмометрии - определение молекулярной массы (М) полимеров. Значения М вычисляют из соотношения 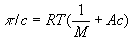 , где с - концентрация полимера по массе; А - коэффициент, зависящий от строения макромолекулы. , где с - концентрация полимера по массе; А - коэффициент, зависящий от строения макромолекулы.
О может достигать значительных величин. Например, 4%-ный раствор при комнатной температуре имеет О около 0,3 Мн/м2, а 53%-ный - около 10 Мн/м2; О морской воды около 0,27 Мн/м2.
Л. А. Шиц.
О в клетках животных, растений, микроорганизмов и в биологических жидкостях зависит от концентрации веществ, растворенных в их жидких средах. Солевой состав биологических жидкостей и клеток, характерный для организмов каждого вида, поддерживается избирательной проницаемостью биологических мембран для разных солей и активным транспортом ионов. Относительное постоянство О обеспечивается водно-солевым обменом, т. е. всасыванием, распределением, потреблением и выделением воды и солей (см. Выделение, Выделительная система, Осморегуляция). У т. н. гиперосмотических организмов внутреннего О больше внешнего, у гипоосмотических - меньше внешнего; у изоосмотических (пойкилоосмотических) внутреннее О равно внешнему. В первом случае ноны активно поглощаются организмом и задерживаются в нем, а вода поступает через биологич. мембраны пассивно, в соответствии с осмотическим градиентом. Гиперосмотическая регуляция свойственна пресноводным организмам, мор. хрящевым рыбам (акулы, скаты) и всем растениям. У организмов с гипоосмотической регуляцией имеются приспособления для активного выделения солей. У костистых рыб преобладающие в океанических водах ионы + и - выделяются через жабры, у морских пресмыкающихся (змеи и черепахи) и у птиц - через особые солевые расположенные в области головы. Ионы 2+, 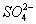 , , 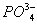 у этих организмов выделяются через почки. О у гипер- и гипоосмотических организмов может создаваться как за счет ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О на 60% создается за счет мочевины и триметиламмония; в плазме крови млекопитающих - главным образом за счет ионов + и -; в личинках насекомых - за счет разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О определяется О внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные). у этих организмов выделяются через почки. О у гипер- и гипоосмотических организмов может создаваться как за счет ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О на 60% создается за счет мочевины и триметиламмония; в плазме крови млекопитающих - главным образом за счет ионов + и -; в личинках насекомых - за счет разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О определяется О внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные).
Диапазон средних величин О в клетках организмов, не способных поддерживать осмотический гомеостаз, довольно широк и зависит от вида и возраста организма, типа клеток и О окружающей среды. В оптимальных условиях О клеточного сока наземных органов болотных растений колеблется от 2 до 16 ат, у степных - от 8 до 40 ат. В разных клетках растения О может резко различаться (так, у мангровых О клеточного сока около 60 ат, а О в сосудах ксилемы не превышает 1-2 ат). У гомойосмотических организмов, т. е. способных поддерживать относительное постоянство О, средней величины и диапазон колебаний О различны (дождевой червь - 3,6-4,8 ат, пресноводные рыбы - 6,0-6,6, океанические костистые рыбы - 7,8-8,5, акуловые - 22,3-23,2, млекопитающие - 6,6-8,0 ат). У млекопитающих О большинства биологических жидкостей равно О крови (исключение составляют жидкости, выделяемые некоторыми - слюна, пот, моча и др.). О, создаваемое в клетках животных высокомолекулярными соединениями ( полисахариды и др.), незначительно, но играет важную роль в обмене веществ (см. Онкотическое давление).
Ю. В. Наточин, В. В. Кабанов.
Лит.: Мелвин-Хьюз Э. А., Физическая пер. с англ., кн. 1-2, М., 1962; Курс физической химии, под ред. Я. И. Герасимова, т. 1-2, М. - Л., 1963-1966; Пасынский А. Г., Коллоидная 3 изд., М., 1968: Проссер Л., Браун Ф., Сравнительная физиология животных, пер. с англ., М., 1967; Гриффин Д., Новик Эл., Живой организм, пер. с англ., 1973; Нобел П., Физиология растительной клетки (физико- подход), пер. с англ., М., 1973.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 24.02.2026 19:39:40
|

|

|
 |
|

|
 |
 |
 |
|