
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Натрий | (далее Н)(Natrium), , элемент группы периодической системы номер 11, масса 22,9898; мягкий металл, на воздухе быстро окисляющийся с поверхности. Природный элемент состоит из одного стабильного изотопа 23.
Историческая справка. Природные соединения Н - поваренная соль , сода 23 - известны с глубокой древности. Название "натрий", происходящее от араб. натрун, греч. nitron, первоначально относилось к природной соде. Уже в 18 в. химики знали много др. соединений Н Однако сам металл был получен лишь в 1807 Г. Дэви электролизом едкого натра . В Великобритании, США, элемент называется Sodium (от исп. слова soda - сода), в Италии - sodio.
Распространение в природе. Н - типичный элемент верхней части земной коры. Среднее содержание его в литосфере 2,5% по массе, в кислых изверженных породах (граниты и др.) 2,77, в основных (базальты и др.) 1,94, в ультраосновных (породы мантии) 0,57. Благодаря изоморфизму + и 2+, обусловленному близостью их ионных радиусов, в магматических породах образуются полевые шпаты (плагиоклазы). В биосфере происходит резкая дифференциация Н осадочные породы в среднем обеднены Н (в глинах и сланцах 0,66%), мало его в большинстве почв (среднее 0,63%). Общее число минералов Н 222. слабо задерживается на континентах и приносится реками в моря и океаны, где его среднее содержание 1,035% ( - главный металлический элемент морской воды). При испарении в прибрежно-морских лагунах, а также в континентальных озерах степей и пустынь осаждаются соли Н формирующие толщи соленосных пород. Главные минералы, являющиеся источником Н и его соединений, - галит (каменная соль) , чилийская селитра 3, тенардит 24, мирабилит 24·102, трона (3)2×22. Мировая добыча Н оценивается 1×108 т. - важный биоэлемент, в живом веществе в среднем содержится 0,02% ; в животных его больше, чем в растениях.
Физические и свойства. При обычной температуре Н в кубической решетке, а = 4,28 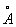 . радиус 1,86 . радиус 1,86 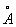 , ионный радиус + 0,92 , ионный радиус + 0,92 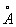 . Плотность 0,968 г/см3 (19,7 °С), tпл 97,83 °С, tkип 882,9 °С; удельная теплоемкость (20 °С) 1,23×103 дж/(кг×К) или 0,295 кал/(г×град); коэффициент теплопроводности 1,32×102 вт/(м×К) или 0,317 кал/(см×сек×град); температурный коэффициент линейного расширения (20 °С) 7,1×10-5 удельное электрическое сопротивление (0 °С) 4,3·0-8 ом×м (4,3·0-6 ом×см). Н парамагнитен, удельная восприимчивость + 9,2×10-6; весьма пластичен и мягок (легко режется ножом). . Плотность 0,968 г/см3 (19,7 °С), tпл 97,83 °С, tkип 882,9 °С; удельная теплоемкость (20 °С) 1,23×103 дж/(кг×К) или 0,295 кал/(г×град); коэффициент теплопроводности 1,32×102 вт/(м×К) или 0,317 кал/(см×сек×град); температурный коэффициент линейного расширения (20 °С) 7,1×10-5 удельное электрическое сопротивление (0 °С) 4,3·0-8 ом×м (4,3·0-6 ом×см). Н парамагнитен, удельная восприимчивость + 9,2×10-6; весьма пластичен и мягок (легко режется ножом).
Нормальный электродный потенциал Н 2,74 в; электродный потенциал в расплаве - 2,4 в. Пары Н окрашивают пламя в характерный ярко-желтый цвет. Конфигурация внешних электронов 3s1; во всех известных соединениях Н одновалентен. Его активность очень высока. При непосредственном взаимодействии с в зависимости от условий образуются окись 2 или перекись 22 - бесцветные вещества. С водой Н образует гидроокись и Н2; реакция может сопровождаться взрывом. Минеральные кислоты образуют с Н соответствующие растворимые в воде соли, однако по отношению к 98-100%-ной серной кислоте Н сравнительно инертен.
Реакция Н с начинается при 200 °С и приводит к получению гидрида - бесцветного гигроскопичного вещества. С и Н взаимодействует непосредственно уже при обычной температуре, с - только при нагревании; с прямого взаимодействия не наблюдается. С серой реагирует бурно, образуя натрия сульфид. Взаимодействие паров Н с в поле тихого электрического разряда приводит к образованию нитрида 3, а с при 800-900 °С - к получению карбида 22.
Н растворяется в жидком аммиаке (34,6 г на 100 г 3 при 0 °С) с образованием аммиачных комплексов. При пропускании газообразного аммиака через расплавленный Н при 300-350 °С образуется 2 - бесцветное вещество, легко разлагаемое водой. Известно большое число соединений, которые по свойствам весьма сходны с соединениями, но превосходят их по реакционной способности. Применяют соединения в органическом синтезе как алкилирующие агенты.
Н входит в состав многих практически важных сплавов. Сплавы - К, содержащие 40-90% К (по массе) при температуре около 25 °С, - жидкости, отличающиеся высокой активностью, воспламеняющиеся на воздухе. Электропроводность и теплопроводность жидких сплавов - К ниже соответствующих величин для и К. Амальгамы Н легко получаются при введении металлического Н в при содержании свыше 2,5% (по массе) при обычной температуре являются уже твердыми веществами.
Получение и применение. Основной промышленный метод получения Н - электролиз расплава поваренной соли , содержащей добавки , , 2 и др., которые снижают температуру плавления соли до 575-585 °С. Электролиз чистого привел бы к большим потерям Н от испарения, т.к. температуры плавления (801 °С) и кипения (882,9 °С) очень близки. Электролиз проводят в электролизерах с диафрагмой, катоды изготовляют из или меди, аноды - из графита. Одновременно с Н получают хлор. Сохранился и старый способ получения Н - электролиз расплавленного едкого натра , который значительно дороже , однако электролитически разлагается при более низкой температуре (320-330 °С).
Н и его сплавы широко применяются как теплоносители для процессов, требующих равномерного обогрева в интервале 450-650 °С - в клапанах авиационных двигателей и особенно в ядерных энергетических установках. В последнем случае жидко-металлическими теплоносителями служат сплавы - К (оба элемента имеют малые сечения поглощения тепловых нейтронов, для 0,49 барн); эти сплавы отличаются высокими температурами кипения и коэффициентами теплопередачи и не взаимодействуют с конструкционными материалами при высоких температурах, развиваемых в энергетических ядерных реакторах. Соединение (10% по массе) применяется в производстве тетраэтилсвинца-наиболее эффективного антидетонатора. В сплаве на основе (0,73% , 0,58% и 0,04% ), применяемом для изготовления осевых подшипников ж.-д. вагонов, Н является упрочняющей добавкой. В металлургии Н служит активным восстановителем при получении некоторых редких металлов (, , ) методами металлотермии; в органическом синтезе - в реакциях восстановления, конденсации, полимеризации и др. О применении соединений Н см. Натрия бромид, Натрия гидроокись, Натрия сульфат, Натрия хлорид, Натриевая селитра, Сода и др.
Вследствие большой активности Н обращение с ним требует осторожности. Особенно опасно попадание на Н воды, которое может привести к пожару и взрыву. Глаза должны быть защищены очками, руки - толстыми резиновыми перчатками; соприкосновение Н с влажной кожей или одеждой может вызвать тяжелые ожоги.
В. Е. Плющев.
в организме. Н - один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль/кг, в сыворотке крови 143 ммоль/кг); участвует в поддержании осмотического давления и кислотно-щелочного равновесия, в проведении нервных импульсов (см. Мембранная теория возбуждения). Суточная потребность человека в колеблется от 2 до 10г и зависит от количества этой соли, теряемой с потом. Концентрация ионов Н в организме регулируется в основном гормоном коры надпочечников - альдостероном. Несмотря на относительно высокое содержание Н в тканях растений (около 0,01% на сырую массу), его роль в жизни растений изучена недостаточно. У галофитов (виды, произрастающие на сильно засоленных почвах) Н создает высокое осмотическое давление в клеточном соке и тем самым способствует извлечению воды из почвы. См. также Водно-солевой обмен.
И. Ф. Грибовская.
В медицине из препаратов Н наиболее часто применяют натрия сульфат, (при кровопотерях, потерях жидкости, рвоте и т.п.), борат 247×102 (как антисептическое средство), гидрокарбонат 3 (как отхаркивающее средство, а также для промываний и полосканий при ринитах, ларингитах и др.), тиосульфат 223×52 (противовоспалительное, десенсибилизирующее и противотоксическое средство) и цитрат 3657×51/22 (препарат из группы антикоагулянтов).
Искусственно полученные радиоактивные изотопы 22 (период полураспада T1/2 = 2,64 г.) и 24 (T1/2 = 15 ч) применяют для определения скорости кровотока в отдельных участках кровеносной системы при сердечно-сосудистых и легочных заболеваниях, облитерирующем эндартериите и др. Радиоактивные растворы солей Н (например, 24) используют также для определения сосудистой проницаемости, изучения общего содержания обменного Н в организме, водно-солевого обмена, всасывания из кишечника, процессов нервной деятельности и в некоторых др. экспериментальных исследованиях.
М. Д. Дорфман.
Лит.: Ситтиг М., его производство, свойства и применение, пер. с англ., М., 1961; Ullmanns Encykiopädie der technihen Chemie, 3 Aufl., Bd 12, Münch. - ., 1960: Реформатский И. А., в кн.: Краткая энциклопедия, т. 3, М., 1964; Рипан Р., Четяну И., Неорганическая т. 1, пер. с рум., М., 1971; Проссер Л., Браун Ф., Сравнительная физиология животных, пер. с англ., М., 1967.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 22:44:07
|

|

|
 |
|

|
 |
 |
 |
|