
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Молекулярные спектры | Молекулярные спектры (далее М) оптические спектры испускания и поглощения, а также комбинационного рассеяния света, принадлежащие свободным или слабо связанным между собой молекулам. М имеют сложную структуру. Типичные М - полосатые, они наблюдаются в испускании и поглощении и в комбинационном рассеянии в виде совокупности более или менее узких полос в ультрафиолетовой, видимой и близкой инфракрасной областях, распадающихся при достаточной разрешающей силе применяемых спектральных приборов на совокупность тесно расположенных линий. Конкретная структура М различна для различных молекул и, вообще говоря, усложняется с увеличением числа в молекуле. Для весьма сложных молекул видимые и ультрафиолетовые спектры состоят из немногих широких сплошных полос; спектры таких молекул сходны между собой.
М возникают при квантовых переходах между уровнями энергии E` и E" молекул согласно соотношению
hn = E` - E", (1)
где hn - энергия испускаемого поглощаемого фотона частоты n (h - Планка постоянная). При комбинационном рассеянии hn равно разности энергий падающего и рассеянного фотонов. М гораздо сложнее линейчатых спектров, что определяется большей сложностью внутренних движений в молекуле, чем в Наряду с движением электронов относительно двух или более ядер в молекулах происходят колебательное движение ядер (вместе с окружающими их внутренними электронами) около положений равновесия и вращательное движение молекулы как целого. Этим трем видам движений - электронному, колебательному и вращательному - соответствуют три типа уровней энергии и три типа спектров.
Согласно квантовой механике, энергия всех видов движения в молекуле может принимать лишь определенные значения, т. е. она квантуется. Полная энергия молекулы E приближенно может быть представлена в виде суммы квантованных значений энергий трех видов ее движения:
E = Eэл + Eкол + Eвращ. (2)
По порядку величин
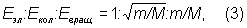
где m - масса электрона, а величина М имеет порядок массы ядер в молекуле, т. е. m/М ~ 10-3-10-5, следовательно:
Eэл >> Eкол >> Eвращ. (4)
Обычно Eэл порядка нескольких эв (несколько сотен кдж/моль), Eкол ~ 10-2-10-1 эв, Eвращ ~ 10-5-10-3 эв.
В соответствии с (4) система уровней энергии молекулы характеризуется совокупностью далеко отстоящих друг от друга электронных уровней (различные значения Eэл при Eкол = Eвращ = 0), значительно ближе друг к другу расположенных колебательных уровней (различные значения Eкол при заданном Eл и Eвращ = 0) и еще более близко расположенных вращательных уровней (различные значения Eвращ при заданных Eэл и Eкол). На рис. 1 приведена схема уровней двухатомной молекулы; для многоатомных молекул система уровней еще более усложняется.
Электронные уровни энергии (Eэл в (2) и на схеме рис. 1 соответствуют равновесным конфигурациям молекулы (в случае двухатомной молекулы характеризуемым равновесным значением r0 межъядерного расстояния r, см. рис. 1 в ст. Молекула). Каждому электронному состоянию соответствуют определенная равновесная конфигурация и определенное значение Eэл; наименьшее значение соответствует основному уровню энергии.
Набор электронных состояний молекулы определяется свойствами ее электронной оболочки. В принципе значения Eэл можно рассчитать методами квантовой химии, однако данная задача может быть решена только с помощью приближенных методов и для сравнительно простых молекул. Важнейшую информацию об электронных уровнях молекулы (расположение электронных уровней энергии и их характеристики), определяемую ее строением, получают, изучая ее М
Весьма важная характеристика заданного электронного уровня энергии - значение квантового числа , характеризующего абсолютную величину полного спинового момента всех электронов молекулы. устойчивые молекулы имеют, как правило, четное число электронов, и для них = 0, 1, 2... (для основного электронного уровня типично значение = 0, а для возбужденных - = 0 и = 1). Уровни с = 0 называются синглетными, с = 1 - триплетными (т. к. взаимодействие в молекуле приводит к их расщеплению на c = 2 + 1 = 3 подуровня; см. Мультиплетность). Радикалы свободные имеют, как правило, нечетное число электронов, для них = 1/2, 3/2, ... и типично как для основного, так и для возбужденных уровней значение = 1/2 (дублетные уровни, расщепляющиеся на c = 2 подуровня).
Для молекул, равновесная конфигурация которых обладает симметрией, электронные уровни можно дополнительно классифицировать. В случае двухатомных и линейных трехатомных молекул, имеющих ось симметрии (бесконечного порядка), проходящую через ядра всех (см. рис. 2, б), электронные уровни характеризуются значениями квантового числа l, определяющего абсолютную величину проекции полного орбитального момента всех электронов на ось молекулы. Уровни с l = 0, 1, 2, ... обозначаются соответственно , П, D..., а величина c указывается индексом слева вверху (например, 3, 2p, ...). Для молекул, обладающих центром симметрии, например 2 и 66 (см. рис. 2, б, в), все электронные уровни делятся на четные и нечетные, обозначаемые индексами g и u (в зависимости от того, сохраняет ли волновая функция знак при обращении в центре симметрии или меняет его).
Колебательные уровни энергии (значения Екол) можно найти квантованием колебательного движения, которое приближенно считают гармоническим. В простейшем случае двухатомной молекулы (одна колебательная степень свободы, соответствующая изменению межъядерного расстояния r) ее рассматривают как гармонический осциллятор; его квантование дает равноотстоящие уровни энергии:
Eкол = hne (u + 1/2), (5)
где ne - основная частота гармонических колебаний молекулы, u - колебательное квантовое число, принимающее значения 0, 1, 2, ... На рис. 1 показаны колебательные уровни для двух электронных состояний.
Для каждого электронного состояния многоатомной молекулы, состоящей из ( ³ 3) и имеющей f колебательных степеней свободы (f = 3 - 5 и f = 3 - 6 для линейных и нелинейных молекул соответственно), получается f т. н. нормальных колебаний с частотами ni (i = 1, 2, 3, ..., f) и сложная система колебательных уровней:
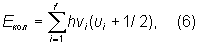
где ui = 0, 1, 2, ... - соответствующие колебательные квантовые числа. Набор частот нормальных колебаний в основном электронном состоянии является очень важной характеристикой молекулы, зависящей от ее строения. В определенном нормальном колебании участвуют все молекулы или часть их; при этом совершают гармонические колебания с одной частотой vi, но с различными амплитудами, определяющими форму колебания. Нормальные колебания разделяют по их форме на валентные (при которых изменяются длины линий связи) и деформационные (при которых изменяются углы между связями - валентные углы). Число различных частот колебаний для молекул низкой симметрии (не имеющих осей симметрии порядка выше 2) равно 2, и все колебания являются невырожденными, а для более симметричных молекул имеются дважды и трижды вырожденные колебания (пары и тройки совпадающих по частоте колебаний). Например, у нелинейной трехатомной молекулы 2 (рис. 2, а) f = 3 и возможны три невырожденных колебания (два валентных и одно деформационное). Более симметричная линейная трехатомная молекула 2 (рис. 2, б) имеет f = 4 - два невырожденных колебания (валентных) и одно дважды вырожденное (деформационное). Для плоской высокосимметричной молекулы 66 (рис. 2, в) получается f = 30 - десять невырожденных и 10 дважды вырожденных колебаний; из них 14 колебаний происходят в плоскости молекулы (8 валентных и 6 деформационных) и 6 неплоских деформационных колебаний - перпендикулярно этой плоскости. Еще более симметричная тетраэдрическая молекула 4 (рис. 2, г) имеет f = 9 - одно невырожденное колебание (валентное), одно дважды вырожденное (деформационное) и два трижды вырожденных (одно валентное и одно деформационное).
Вращательные уровни энергии можно найти квантованием вращательного движения молекулы, рассматривая ее как твердое тело с определенными моментами инерции. В простейшем случае двухатомной или линейной многоатомной молекулы ее энергия вращения
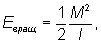
где - момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М - вращательный момент количества движения. Согласно правилам квантования,
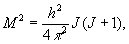
где вращательное квантовое число J = 0, 1, 2, ..., и, следовательно, для Eвращ получили:
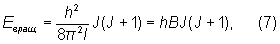
где вращательная постоянная 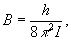 определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний. На рис. 1 показаны вращательные уровни для каждого электронно-колебательного состояния. определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний. На рис. 1 показаны вращательные уровни для каждого электронно-колебательного состояния.
Различные типы М возникают при различных типах переходов между уровнями энергии молекул. Согласно (1) и (2)
DE = E` - E" = DEэл + DEкол + DEвращ, (8)
где изменения DEэл, DEкол и DEвращ электронной, колебательной и вращательной энергий удовлетворяют условию:
DEэл >> DEкол >> DEвращ (9)
(расстояния между уровнями того же порядка, что и сами энергии Eэл, Eол и Eвращ, удовлетворяющие условию (4)).
При DE эл ¹ 0 получаются электронные М, наблюдаемые в видимой и в ультрафиолетовой (УФ) областях. Обычно при DEэл ¹ 0 одновременно DEкол ¹ 0 и DEвращ ¹ 0; различным DEкол при заданном DEэл соответствуют различные колебательные полосы (рис. 3), а различным DEвращ при заданных DEэл и DEкол - отдельные вращательные линии, на которые распадается данная полоса; получается характерная полосатая структура (рис. 4). Совокупность полос с заданным DEэл (соответствующим чисто электронному переходу с частотой vэл = DEэл/h) называемая системой полос; отдельные полосы обладают различной интенсивностью в зависимости от относительных вероятностей переходов (см. Квантовые переходы), которые могут быть приближенно рассчитаны квантовомеханическими методами. Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу, могут накладываться друг на друга и несколько таких широких полос. Характерные дискретные электронные спектры наблюдаются в замороженных растворах органических соединений (см. Шпольского эффект). Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются экспериментально при помощи спектрографов и спектрометров со стеклянной (для видимой области) и кварцевой (для УФ-области) оптикой, в которых для разложения света в спектр применяются призмы или дифракционные решетки (см. Спектральные приборы).
При DEэл = 0, а DEкол ¹ 0 получаются колебательные М, наблюдаемые в близкой (до нескольких мкм) и в средней (до нескольких десятков мкм) инфракрасной (ИК) области, обычно в поглощении, а также в комбинационном рассеянии света. Как правило, одновременно DEвращ ¹ 0 и при заданном Eкол получается колебательная полоса, распадающаяся на отдельные вращательные линии. Наиболее интенсивны в колебательных М полосы, соответствующие Du = u` - u" = 1 (для многоатомных молекул - Dui = ui` - ui"= 1 при Duk = uk` - uk" = 0, где k ¹ i).
Для чисто гармонических колебаний эти отбора правила, запрещающие др. переходы, выполняются строго; для ангармонических колебаний появляются полосы, для которых Du > 1 (обертоны); их интенсивность обычно мала и убывает с увеличением Du.
Колебательные (точнее, колебательно-вращательные) спектры изучаются экспериментально в ИК-области в поглощении при помощи ИК-спектрометров с призмами, прозрачными для ИК-излучения, или с дифракционными решетками, а также Фурье-спектрометров и в комбинационном рассеянии при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения.
При DEэл = 0 и DEкол = 0 получаются чисто вращательные М, состоящие из отдельных линий. Они наблюдаются в поглощении в далекой (сотни мкм) ИК-области и особенно в микроволновой области, а также в спектрах комбинационного рассеяния. Для двухатомных и линейных многоатомных молекул (а также для достаточно симметричных нелинейных многоатомных молекул) эти линии равно отстоят (в шкале частот) друг от друга с интервалами Dn = 2 в спектрах поглощения и Dn = 4 в спектрах комбинационного рассеяния.
Чисто вращательные спектры изучают в поглощении в далекой ИК-области при помощи ИК-спектрометров со специальными дифракционными решетками (эшелеттами) и Фурье-спектрометров, в микроволновой области при помощи микроволновых (СВЧ) спектрометров (см. Микроволновая спектроскопия), а также в комбинационном рассеянии при помощи светосильных спектрографов.
Методы молекулярной спектроскопии, основанные на изучении М, позволяют решать разнообразные задачи химии, биологии и др. наук (например, определять состав нефтепродуктов, полимерных веществ и т. п.). В химии по М изучают структуру молекул. Электронные М дают возможность получать информацию об электронных оболочках молекул, определять возбужденные уровни и их характеристики, находить энергии диссоциации молекул (по схождению колебательных уровней молекулы к границам диссоциации). Исследование колебательных М позволяет находить характеристические частоты колебаний, соответствующие определенным типам связей в молекуле (например, простых двойных и тройных связей С-С, связей С-Н, -Н, О-Н для органических молекул), различных групп (например, 2, 3, 2), определять пространственную структуру молекул, различать цис- и транс-изомеры. Для этого применяют как инфракрасные спектры поглощения (ИКС), так и спектры комбинационного рассеяния (СКР). Особенно широкое распространение получил метод ИКС как один из самых эффективных оптических методов изучения строения молекул. Наиболее полную информацию он дает в сочетании с методом СКР. Исследование вращательных М, а также вращательной структуры электронных и колебательных спектров позволяет по найденным из опыта значениям моментов инерции молекул (которые получаются из значений вращательных постоянных, см. (7)) находить с большой точностью (для более простых молекул, например 2) параметры равновесной конфигурации молекулы - длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопических молекул (в частности, в которых заменен дейтерием), имеющих одинаковые параметры равновесных конфигураций, но различные моменты инерции.
В качестве примера применения М для определения строения молекул рассмотрим молекулу бензола 66. Изучение ее М подтверждает правильность модели, согласно которой молекула плоская, а все 6 связей С-С в бензольном кольце равноценные и образуют правильный шестиугольник (рис. 2, б), имеющий ось симметрии шестого порядка, проходящую через центр симметрии молекулы перпендикулярно ее плоскости. Электронный М поглощения 66 состоит из нескольких систем полос, соответствующих переходам из основного четного синглетного уровня на возбужденные нечетные уровни, из которых первый является триплетным, а более высокие - синглетными (рис. 5). Наиболее интенсивна система полос в области 1840  (E5 - E1= 7,0 эв), наиболее слаба система полос в области 3400 (E5 - E1= 7,0 эв), наиболее слаба система полос в области 3400  (E2 - E1 = 3,8 эв), соответствующая синглетно-триплетному переходу, запрещенному приближенными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. p-электронов, делокализованных по всему бензольному кольцу (см. Молекула); полученная из электронных молекулярных спектров схема уровней рис. 5 находится в согласии с приближенными квантовомеханическими расчетами. Колебательные М 66 соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний 66 4 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в см-1): 673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры 66 (и аналогичные им колебательные спектры 6D6) находятся в очень хорошем согласии с теоретическими расчетами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний. (E2 - E1 = 3,8 эв), соответствующая синглетно-триплетному переходу, запрещенному приближенными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. p-электронов, делокализованных по всему бензольному кольцу (см. Молекула); полученная из электронных молекулярных спектров схема уровней рис. 5 находится в согласии с приближенными квантовомеханическими расчетами. Колебательные М 66 соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний 66 4 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в см-1): 673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры 66 (и аналогичные им колебательные спектры 6D6) находятся в очень хорошем согласии с теоретическими расчетами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний.
Подобным же образом можно при помощи М определять структуру разнообразных классов органических и неорганических молекул, вплоть до весьма сложных, например молекул полимеров.
Лит.: Кондратьев В. Н., Структура и молекул, 2 изд., М., 1959; Ельяшевич М. А., и молекулярная спектроскопия, М., 1962; Герцберг Г., Спектры и строение двухатомных молекул, пер. с англ., М., 1949; его же, Колебательные и вращательные спектры многоатомных молекул, пер. с англ., М., 1949; его же, Электронные спектры и строение многоатомных молекул, пер. с англ., М., 1969; Применение спектроскопии в химии, под ред. В. Веста, пер. с англ., М., 1959.
М. А. Ельяшевич.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:45:48
|

|

|
 |
|

|
 |
 |
 |
|