
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Литий | (далее Л)(лат. Lithium), , элемент 1 группы периодической системы номер 3, масса 6,941, относится к щелочным металлам. Природный Л состоит из двух стабильных изотопов - 6 (7,42%) и 7 (92,58%).
Л был открыт в 1817 шведским химиком А. Арфведсоном в минерале петалите; название от греч. líthos - камень. Металлический Л впервые получен в 1818 английским химиком Г. Дэви.
Распространение в природе. Л - типичный элемент земной коры (содержание 3,2×10-3% по массе), он накапливается в наиболее поздних продуктах дифференциации магмы - пегматитах. В мантии мало Л - в ультраосновных породах всего 5×10-3% (в основных 1,5×10-3%, средних - 2×10-3%, кислых 4×10-3%). Близость ионных радиусов +, 2+ и 2+ позволяет Л входить в решетки магнезиально- силикатов - пироксенов и амфиболов. В гранитоидах он содержится в виде изоморфной примеси в слюдах. Только в пегматитах и в биосфере известно 28 самостоятельных минералов Л (силикаты, фосфаты и др.). Все они редкие (см. Литиевые руды). В биосфере Л мигрирует сравнительно слабо, роль его в живом веществе меньше, чем остальных щелочных металлов. Из вод он легко извлекается глинами, его относительно мало в Мировом океане (1,5×10-5%). Промышленные месторождения Л связаны как с магматическими породами (пегматиты, пневматолиты), так и с биосферой (соленые озера).
Физические и свойства. Компактный Л - металл, быстро покрывающийся темно-серым налетом, состоящим из нитрида 3 и окиси 2. При обычной температуре Л в кубической объемноцентрированной решетке, а = 3,5098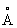 . радиус 1,57 . радиус 1,57 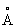 , ионный радиус + 0,68 , ионный радиус + 0,68 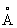 . Ниже -195°С решетка Л гексагональная плотноупакованная. Л - самый легкий металл; плотность 0,534 г/см3 (20°С); tпл. 180,5°С, tkип. 1317°С. Удельная теплоемкость (при 0-100°С) 3,31(103 дж/(кг×К), т. е. 0,790 кал/(г·град); термический коэффициент линейного расширения 5,6×10-5. Удельное электрическое сопротивление (20°С) 9,29×10-8 ом·м (9,29 мком·см); температурный коэффициент электрического сопротивления (0-100°С) 4,50×10-3. Л парамагнитен. Металл весьма пластичен и вязок, хорошо обрабатывается прессованием и прокаткой, легко протягивается в проволоку. Твердость по Моосу 0,6 (тверже, чем и К), легко режется ножом. Давление истечения (15-20°С) 17 Мн/м2 (1,7 кгс/мм2). Модуль упругости 5 Гн/м2 (500 кгс/мм2), предел прочности при растяжении 116 Мн/м2 (11,8 кгс/мм2), относительное удлинение 50-70%. Пары Л окрашивают пламя в карминово-красный цвет. . Ниже -195°С решетка Л гексагональная плотноупакованная. Л - самый легкий металл; плотность 0,534 г/см3 (20°С); tпл. 180,5°С, tkип. 1317°С. Удельная теплоемкость (при 0-100°С) 3,31(103 дж/(кг×К), т. е. 0,790 кал/(г·град); термический коэффициент линейного расширения 5,6×10-5. Удельное электрическое сопротивление (20°С) 9,29×10-8 ом·м (9,29 мком·см); температурный коэффициент электрического сопротивления (0-100°С) 4,50×10-3. Л парамагнитен. Металл весьма пластичен и вязок, хорошо обрабатывается прессованием и прокаткой, легко протягивается в проволоку. Твердость по Моосу 0,6 (тверже, чем и К), легко режется ножом. Давление истечения (15-20°С) 17 Мн/м2 (1,7 кгс/мм2). Модуль упругости 5 Гн/м2 (500 кгс/мм2), предел прочности при растяжении 116 Мн/м2 (11,8 кгс/мм2), относительное удлинение 50-70%. Пары Л окрашивают пламя в карминово-красный цвет.
Конфигурация внешней электронной оболочки Л 2s1; во всех известных соединениях он одновалентен. При взаимодействии с или при нагревании на воздухе (горит голубым пламенем) Л образует окись 2 (перекись 22 получается только косвенным путем). С водой реагирует менее энергично, чем др. щелочные металлы, при этом образуются гидроокись и Минеральные кислоты энергично растворяют (стоит первым в ряду напряжений, его нормальный электродный потенциал - 3,02 в).
Л соединяется с галогенами (с при нагревании), образуя галогениды (важнейший - лития хлорид). При нагревании с серой Л дает сульфид 2, а с - лития гидрид. С Л медленно реагирует уже при комнатной температуре, энергично - при 250°С с образованием нитрида 3. С Л непосредственно не взаимодействует, но в специальных условиях могут быть получены фосфиды 3, , 22. Нагревание Л с приводит к получению карбида 22, с - силицида Л Бинарные соединения Л - 2, , 3, 22, и др., a также весьма реакционноспособны; при нагревании или плавлении они разрушают многие металлы, фарфор, кварц и др. материалы. Карбонат (см. Лития карбонат), , фосфат 34 и др. соединения Л по условиям образования и свойствам близки к соответствующим производным и
Л образует многочисленные литийорганические соединения, что определяет его большую роль в органическом синтезе.
Л - компонент многих сплавов. С некоторыми металлами (, , ) он образует твердые растворы значительной концентрации, со многими - интерметаллиды (, , 2, и мн. др.). Последние часто весьма тверды и тугоплавки, незначительно изменяются на воздухе; некоторые из них - полупроводники. Изучено более 30 бинарных и ряд тройных систем с участием Л соответствующие им сплавы уже нашли применение в технике.
Получение и применение. Соединения Л получаются в результате гидрометаллургической переработки концентратов - продуктов обогащения литиевых руд. Основной силикатный минерал - сподумен перерабатывают по известковому, сульфатному и сернокислотному методам. В основе первого - разложение сподумена известняком при 1150-1200°С:
2×23×42 + 83 = 223 + 4(2×2) + 82.
При выщелачивании спека водой в присутствии избытка извести алюминат Л разлагается с образованием гидроокиси Л
2×23 + ()2 = 2 + ×23.
По сульфатному методу сподумен (и др. алюмосиликаты) спекают с сульфатом
2×23×42 + 24 = 24 + 2×23×42.
Сульфат Л растворяют в воде и из его раствора содой осаждают карбонат Л
24 + 23 = 23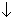 + 24. + 24.
По сернокислотному методу также получают сначала раствор сульфата Л а затем карбонат Л сподумен разлагают серной кислотой при 250-300°С (реакция применима только для b-модификации сподумена):
b-2×23×42 + 24 = 24 + 2×23×42.
Метод используется для переработки руд, необогащенных сподуменом, если содержание в них 2 не менее 1%. Фосфатные минералы Л легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950-1050°С с последующей водной обработкой спеков и осаждением из растворов карбоната Л
Металлический Л получают электролизом расплавленной смеси Л и при 400-460°С (весовое соотношение компонентов 1:1). Электролизные ванны футеруются магнезитом, алундом, муллитом, тальком, графитом и др. материалами, устойчивыми к расплавленному электролиту; анодом служат графитовые, а катодом - стержни. Черновой металлический Л содержит механические включения и примеси (К, , , , , , но главным образом ). Включения удаляются переплавкой, примеси - рафинированием при пониженном давлении. В настоящее время большое внимание уделяется металлотермическим методам получения Л
Важнейшая область применения Л - ядерная энергетика. Изотоп 6 - единственный промышленный источник для производства трития (см. Водород) по реакции:
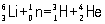 . .
Сечения захвата тепловых нейтронов (s) изотопами Л резко различаются: 6 945, 7 0,033; для естественной смеси 67 (в барнах); это важно в связи с техническим применением Л - при изготовлении регулирующих стержней в системе защиты реакторов. Жидкий Л (в виде изотопа 7) используется в качестве теплоносителя в реакторах. Расплавленный 7 применяется как растворитель соединений и в гомогенных реакторах. Крупнейшим потребителем соединений Л является силикатная промышленность, в которой используют минералы Л , 23 и многие специально получаемые соединения. В черной металлургии Л его соединения и сплавы широко применяют для раскисления, легирования и модифицирования многих марок сплавов. В цветной металлургии литием обрабатывают сплавы для получения хорошей структуры, пластичности и высокого предела прочности. Хорошо известны сплавы, содержащие всего 0,1% Л - аэрон и склерон; помимо легкости, они обладают высокой прочностью, пластичностью, стойкостью против коррозии и очень перспективны для авиастроения. Добавка 0,04% Л к подшипниковым сплавам повышает их твердость и понижает трение. Соединения Л используются для получения пластичных смазок. По значимости в современной технике Л - один из важнейших редких элементов.
В. Е. Плющев.
в организме. Л постоянно входит в состав живых организмов, однако его биологическая роль выяснена недостаточно. Установлено, что у растений Л повышает устойчивость к болезням, усиливает фотохимическую активность в листьях (томаты) и синтез никотина (табак). Способность концентрировать Л сильнее всего выражена среди морских организмов у красных и бурых водорослей, а среди наземных растений - у представителей семейства Ranunculaceae (василистник, лютик) и семейства Solanaceae (дереза). У животных Л концентрируется главным образом в печени и легких.
Лит.: Плющев В. Е., Степин Б. Д., и технология соединений лития, и М., 1970; Ландольт П., Ситтиг М., в кн.: Справочник по редким металлам, пер. с англ., М., 1965. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:52:21
|

|

|
 |
|

|
 |
 |
 |
|