
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Клапейрона - Клаузиуса уравнение | Клапейрона - Клаузиуса уравнение (далее К) термодинамическое уравнение, относящееся к процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно К. - К. у., теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесно протекающем процессе определяется выражением
 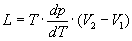 , (1) , (1)
где Т - температура перехода (процесс изотермический), dp/dT - значение производной от давления по температуре при данной температуре перехода, (2-1) - изменение объема вещества при переходе его из первой фазы во вторую.
Первоначально уравнение было получено в 1834 Б. П. Э. Клапейроном из анализа Карно цикла для конденсирующегося пара, находящегося в тепловом равновесии с жидкостью. В 1850 . Клаузиус усовершенствовал уравнение и распространил его на др. фазовые переходы. К. - К. у. применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т. н. фазовым переходом 1 рода), и является прямым следствием условий фазового равновесия, из которых оно и выводится.
К. - К. у. может служить для расчета любой из величин, входящих в уравнение, если остальные известны. В частности, с его помощью рассчитывают теплоты испарения, экспериментальное определение которых сопряжено со значительными трудностями.
Часто К. - К. у. записывают относительно производных dp/dT или dT/dp:
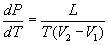 (2) (2)
Для процессов испарения и сублимации dp/dT выражает изменение давления насыщенного пара р с температурой Т, а для процессов плавления и полиморфного превращения dT/dp определяет изменение температуры перехода с давлением. Иными словами, К. - К. у. является дифференциальным уравнением кривой фазового равновесия в переменных р, Т.
Для решения К. - К. у. необходимо знать, как изменяются с температурой и давлением величины L, 1 и 2, что представляет сложную задачу. Обычно эту зависимость устанавливают эмпирически и решают К. - К. у. численно.
К. - К. у. применимо как к чистым веществам, так и к растворам и отдельным компонентам растворов. В последнем случае К. - К. у. связывает парциальное давление насыщенного пара данного компонента с его парциальной теплотой испарения.
Лит.: Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 1, М., 1969.
Ю. И. Поляков. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 02.03.2026 00:44:33
|

|

|
 |
|

|
 |
 |
 |
|