
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Кислоты и основания | Кислоты и основания (далее К) классы соединений. Обычно кислотами называют вещества, содержащие (, 3, 24, 3 и т.д.) и диссоциирующие в воде с образованием ионов Н+ (точнее, ионов гидроксония 3+). Присутствие этих ионов обусловливает характерный острый вкус водных растворов кислот, а также их способность изменять окраску индикаторов химических. По числу отщепляющихся протонов различают кислоты одноосновные (например, 3, соляная , уксусная 3), двухосновные (серная 24, 23), трехосновные (ортофосфорная 34). Чем больше ионов гидроксония присутствует в водном растворе кислоты, т. е. чем выше степень диссоциации последней, тем кислота сильнее. Кислоты, полностью диссоциированные в разбавленных растворах, называют сильными. К слабым относятся кислоты с константой ионизации (характеризующей степень диссоциации кислоты в растворе, например, при 25 °С) ниже 10-5 (уксусная 1,8×10-5, синильная 7,9×10-10). Диссоциация многоосновных кислот происходит в несколько ступеней, каждая из которых имеет свою константу ионизации. Например, константа ионизации 34 на
Н+ и 2-4 7×10-3, 24- на Н+ и 42- 8×10-8, 42- на Н+ и 43- 4,8×10-13. Об органических кислотах см. также Карбоновые кислоты. Основаниями обычно называют вещества, содержащие гидроксильную группу (КОН, , ()2 и др.) и способные диссоциировать в водном растворе с образованием гидроксильных ионов -. Большинство оснований нерастворимо в воде. Растворимые в воде основания называют щелочами. Присутствием ионов - и объясняется характерный щелочной вкус растворов щелочей, а также их способность изменять окраску индикаторов. Основания с 1, 2, 3 гидроксильными группами называются соответственно одно-, двух-, трехкислотными. Не полностью диссоциирующие при растворении в воде основания называются, как и кислоты, слабыми. К сильным основаниям относятся гидроокиси , , ()3. О принципах установления названий К. и о. см. Номенклатура неорганических соединений.
Понятия К. и о. возникли еще на заре развития химии. В 1778 французский химик А. Л. Лавуазье попытался объяснить особенности свойств кислот содержанием Несостоятельность такого мнения стала очевидной, когда оказалось, что многие вещества (окислы металлов, щелочи, соли и др.) не проявляют кислотных свойств, а ряд типичных кислот (соляная, синильная, плавиковая и др.), как показали английский ученый Г. Дэви (1810) и французский ученый Ж. Л. Гей-Люссак (1814), не содержат Шведский химик И. Я. Берцелиус (1812—19) видел причину кислотных и основных свойств в электрической природе окислов: электроотрицательные окислы неметаллов (и некоторых металлов — он считал кислотами, а электроположительные окислы металлов — основаниями. В 1814 Г. Дэви предложил признать носителем кислотных свойств входящий в состав всех известных тогда соединений, обладающих кислотными свойствами, а немецкий химик Ю. Либих (1833) внес существенное уточнение, что кислотные свойства вещества обусловлены не всеми содержащимися в нем а лишь теми из них, которые могут замещаться металлом с образованием солей. После появления (1884—87) теории электролитической диссоциации шведского ученого С. Аррениуса кислотами стали называть соединения, при диссоциации которых в водном растворе образуются ионы Н+, а основаниями — соединения, диссоциирующие с отщеплением иона гидроксила -. По мере развития теории растворов стало ясно, что важную роль в процессе электролитической диссоциации веществ играет взаимодействие как самих веществ, так и продуктов их диссоциации с растворителем. Было выяснено также, что ион Н+ не может находиться в растворе в свободном виде: вследствие очень высокой плотности заряда он прочно соединяется с молекулами растворителя (сольватируется) и реально существует в виде сольватного иона, в водных растворах — иона гидроксония, который и является носителем кислотных свойств.
Определение понятий К. и о. на основе теории электролитической диссоциации часто вполне достаточно для практических целей. Однако, как было установлено уже давно, многие соединения, проявляющие типичные свойства К. и о., не содержат ни ни групп ОН. Кроме того, одно и то же вещество нередко в одних реакциях ведет себя как кислота, а в других — как основание (см. Амфотерность). Способность вещества реагировать как кислота или основание является, таким образом, не абсолютным свойством этого вещества, а выражается в конкретных реакциях, относимых к классу кислотно-основных. В таких реакциях одно из взаимодействующих веществ играет роль кислоты по отношению к другому веществу, играющему роль основания. Итак, способность вещества реагировать в качестве кислоты или основания является его функциональной характеристикой. Было предпринято множество попыток разработать единую теорию, которая позволила бы, с учетом указанных обстоятельств, однозначно относить данное вещество к классу кислот или оснований. Однако до сих пор единого критерия для этого не найдено. Наиболее распространены две концепции — датского физико-химика И. Н. Бренстеда и американского физико-химика Г. Н. Льюиса (1923). Бренстед относит к классу кислот вещества, отдающие при реакциях положительные ионы — протоны (т. н. протонные, или бренстедовские, кислоты), а к классу оснований — вещества, присоединяющие протоны. Функции К. и о., по Бренстеду, могут выполнять как нейтральные молекулы, так и ионы. реакция, при которой происходит передача протона от кислоты к основанию: АН+В- Û А-+ВН (где АН — кислота, а В- — основание), называется кислотно-основной, или протолитической. Поскольку протолитические реакции обратимы, причем в обратной реакции, так же как и в прямой, происходит передача протона, продукты прямой реакции также выполняют друг по отношению к другу функцию К. и о. (так называемые сопряженные К. и о.), то есть ВН — кислота, а А- — основание. Например, в реакции: 24 + 2 Û -4 + 3+ кислотами являются 24, и 3+, а -4 и 2 — основания. Концепция Бренстеда дает четкий критерий для отнесения реакций к типу кислотно-основных, позволяет выражать в количественной форме основные характеристики протолитических равновесий и расположить вещества в ряд по возрастанию их способности отдавать протон, то есть по их кислотности. Эти достоинства теории протолитических равновесий обусловили ее предсказательную силу и обеспечили широкое использование бренстедовских представлений в практике. В то же время концепции Бренстеда свойственна ограниченность, выражающаяся в том, что, связывая кислотные свойства вещества с наличием в его составе она все же оставляет в стороне большое число веществ кислотного характера, не содержащих К таким веществам, получившим в химии название апротонных, или льюисовских, кислот, относятся электронно-ненасыщенные соединения, например галогениды бора, и окислы некоторых металлов и т.д. Согласно концепции Льюиса, восполняющей в какой-то степени вышеуказанный пробел, кислотой называют вещество, присоединяющее при реакции пару электронов, а основанием — вещество, отдающее пару электронов. Результатом является восполнение электронной ненасыщенности молекулы кислоты за счет электронов основания, а также возникновения нового соединения (соли) с устойчивой электронной оболочкой (в частности, октетом) и донорно-акцепторной связью, например:
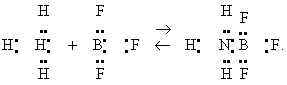
где 3 — кислота, а 3 — основание. Важная особенность кислотно-основных реакций, по Льюису, состоит в обобществлении электронной пары основания. Этим они отличаются от окислительно-восстановительных реакций, в ходе которых молекулы окислителя полностью отбирают по одному или несколько электронов у молекул восстановителя; никаких обобществленных орбит при этом не возникает. В отличие от Бренстеда, Льюис связывает кислотно-основные свойства не с наличием определенных элементов (в частности, а исключительно со строением внешних электронных оболочек В то же время между обеими концепциями имеется внутренняя связь, основанная на том, что для иона Н+, так же как и для льюисовских кислот, характерно сильное сродство к электронной паре. Кроме двух рассмотренных концепций К и о., известны некоторые другие, которые не получили, однако, столь широкого распространения.
Как бренстедоские, так и льюисовские теории К. и о. широко применяются на практике. Изменение кислотности или основности среды часто используют с целью увеличения скорости реакций и изменения механизма взаимодействия. В этом состоит сущность кислотно-основного катализа, широко используемого в промышленности; при этом важно, что бренстедовские и льюисовские кислоты оказывают во многих случаях сходное каталитическое действие. Широкое применение получили кислотно-основные процессы в промышленности (нейтрализация, гидролиз, травление металлов и т.д.). Многие кислоты (серная, соляная, ортофосфорная и др.) и щелочи (едкое едкий натр и др.) являются основными продуктами производства и используются в качестве исходных веществ в важнейших отраслях промышленности.
Многообразные — структурные и динамические — функции К. и о. выполняют в живых организмах, принимая участие во многих биохимических процессах. Как правило, эти процессы очень чувствительны к кислотности или основности среды (см. Водородный показатель, Кислотно-щелочное равновесие). Направленное воздействие К. и о. используется в медицине. Так, разбавленные растворы соляной кислоты употребляются для усиления секреции желудка, борной — для дезинфицирующих и вяжущих полосканий и т.д. В то же время при попадании в организм концентрированных К. и о. возможны сильные ожоги внутренних органов, падение сердечной деятельности и т.д., приводящие в ряде случаев к гибели организма.
Лит.: Людер В., Цуффанти С., Электронная теория кислот и оснований, пер. с англ., М.,1950; Усанович М. И., Что такое кислоты и основания, А.-А., 1953; Полинг Л., Общая пер. с англ., М.. 1964; Краткая энциклопедия, т. 2, М., 1963.
Я. М. Варшавский. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 19.02.2026 02:44:30
|

|

|
 |
|

|
 |
 |
 |
|