
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Кинетика химическая | Кинетика (далее К) кинетика реакций, учение о процессах — о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики реакций связаны важнейшие направления современной химии и промышленности: разработка рациональных принципов управления процессами; стимулирование полезных и торможение и подавление нежелательных реакций; создание новых и усовершенствование существующих процессов и аппаратов в технологии; изучение поведения продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
В реальных условиях, например в крупных промышленных аппаратах, процесс осложняется в связи с передачей тепла, выделяемого или поглощаемого в реакции, транспортом веществ в зону реакции, их искусственным или естественным перемешиванием. Эти проблемы решает так называемая макрокинетика.
Вместе с тем многие уравнения, описывающие протекание во времени реакций, пригодны и для описания ряда физических процессов (распад радиоактивных ядер, деление ядерного горючего), а также для количественной характеристики развития некоторых биохимических, в том числе ферментативных, и других биологических процессов (нормальный и злокачественный рост тканей, развитие лучевого поражения, кинетические критерии оценки эффективности лечения). К лежит в основе исследования сложных процессов горения газов и взрывчатых веществ, помогает изучению процессов в двигателе внутреннего сгорания. Таким образом, можно говорить об общей кинетике, частным случаем которой является кинетика реакций. Эти аналогии весьма удобны для практического использования, но всегда следует иметь в виду принципиальные различия в природе рассматриваемых явлений.
Ввиду сложности реальных систем и необходимости учета большого числа факторов и условий проведения процесса, при выяснении оптимальных режимов получения нужных продуктов в современной К широко используются быстродействующие электронные вычислительные машины.
Историческая справка. Отдельные работы в области К были выполнены еще в середине 19 в. В 1850 немецкий химик Л. Вильгельми изучил скорость инверсии тростникового в 1862—63 М. Бертло — скорость реакций этерификации. В работах Н. А. Меншуткина получили развитие (1882—90) такие основные проблемы химии, как связь между строением веществ и их реакционной способностью, влияние среды на ход превращения. В 80-х гг. 19 в. Я. Вант-Гофф и С. Аррениус сформулировали основные законы, управляющие простыми реакциями, и дали трактовку этих законов, исходя из молекулярно-кинетической теории. Дальнейшее развитие этих работ привело к созданию в 30-х гг. 20 в. Г. Эйрингом и М. Поляни на базе квантовой механики и статистической физики теории абсолютных скоростей реакций, открывающей перспективы расчета скоростей простых (элементарных) реакций, исходя из свойств реагирующих частиц (см. Активированный комплекс).
Параллельно развивались работы по изучению кинетики сложных реакций. Среди первых в этой области были исследования А. Н. Баха и Н. А. Шилова по реакциям окисления. Они включили в предмет К представления о решающей роли промежуточных продуктов и промежуточных реакций в превращении. Большую роль в разработке общих методов подхода к изучению сложных реакций сыграли работы М. Боденштейна. Выдающимся достижением теории сложных процессов явилась созданная в 30-х гг. Н. Н. Семеновым общая теория цепных реакций. Широкие исследования механизма сложных кинетических процессов, особенно цепных реакций, были выполнены С. Н. Хиншелвудом.
Основные понятия и законы. реакция может протекать гомогенно, то есть в объеме одной фазы, и гетерогенно, то есть на границе раздела фаз. Наиболее полно разработана К реакций в газовой фазе, так как она отправляется от хорошо развитой кинетической теории газового состояния. В то же время интенсивно развивается кинетика реакций в жидкой фазе и твердых телах. В зависимости от того, в какой форме подводится к реагирующей системе необходимая для реакций энергия (теплота, свет, электрический ток, излучение, плазма, лазерные пучки, высокие и сверхвысокие давления, ударные волны), они подразделяются на тепловые, фотохимические, электрохимические, радиационно- и др.
В основе К как учения о скоростях превращений лежит действующих масс закон, согласно которому скорость реакции веществ А, В, С,... пропорциональна произведению их концентраций. Скорость реакции характеризуется обычно изменением за единицу времени концентрации какого-либо из исходных веществ или конечных продуктов реакции. Например, скорость вступления в реакцию вещества А (уменьшение его концентрации в единицу времени) выражается уравнением:
— 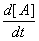 = k (A)a()b()g..., = k (A)a()b()g...,
где к — константа скорости реакции, (А), (В), (С)... — концентрации реагирующих веществ (в качестве действующих веществ могут выступать молекулы, радикалы и ионы, в зависимости от типа реакции); знак минус показывает, что концентрация вещества А убывает со временем. Сумма величин a, b, g... называется порядком реакции. В зависимости от числа молекул, участвующих в элементарном акте взаимодействия, различают реакции мономолекулярные, в которых реагируют отдельные молекулы одного вида, бимолекулярные — протекающие при двойном соударении (при встрече двух молекул), тримолекулярные — при тройном соударении. Реакции, требующие в элементарном акте встречи более трех молекул, мало вероятны. Порядок простой гомогенной реакции совпадает с числом молекул, участвующих в элементарном акте реакции. Однако чаще всего такого совпадения не бывает. В частности, показатели a, b, g... могут быть дробными величинами. Это говорит о том, что реакция имеет сложный механизм, то есть протекает в несколько элементарных стадий, каждая из которых является строго моно-, би- или тримолекулярной реакцией. В тех случаях, когда сложная по существу реакция описывается простым кинетическим уравнением, говорят, что она имитирует простой закон протекания (см. Сложные реакции).
Температурная зависимость скорости реакции определяется уравнением Аррениуса: k-=k0e—E/RT,
где k0 — множитель, который в ряде простейших случаев может быть предвычислен, исходя из молекулярно-кинетических представлений о механизме элементарного акта, е — основание натуральных логарифмов, Е — энергия активации реакции, R — универсальная газовая постоянная, Т — абсолютная температура.
На графически показано убывание со временем концентрации исходных веществ в случае реакций, удовлетворяющих простым законам. Кривые, показывающие изменение концентраций реагирующих веществ со временем, называются кинетическими кривыми.
По механизму процессы делятся на 3 основных типа: простые реакции между молекулами; радикальные, в том числе цепные реакции (протекающие через промежуточное образование свободных радикалов и ионные (идущие при участии ионов).
К реакций между молекулами. Реакции непосредственно между валентно-насыщенными молекулами весьма редки, т.к. происходящая при этом перестройка молекул требует разрыва связей, энергия которых достигает значительных величин (50—100 ккал/моль, или 209,3—418,7 кдж/моль). Поэтому в газовой фазе реакции идут чаще всего как цепные, а в жидкой фазе — и как цепные, и как ионные. Примерами реакций насыщенных молекул в газовой фазе могут служить: 1) мономолекулярная реакция распада азометана: 323 ® 26+2; 2) бимолекулярная реакция превращения нитрозила: +®2+2 и 3) тримолекулярная реакция окисления окиси в двуокись 2+2®22.
Реакции, в которых превращение исходных веществ идет по двум или нескольким направлениям, называются параллельными; механизм и кинетические закономерности реакций в разных направлениях могут быть самыми разнообразными — простыми и сложными (см. Параллельные реакции). Реакции, в которых превращение исходных веществ в конечные продукты происходит через несколько следующих друг за другом стадий с образованием промежуточных продуктов, называются последовательными (см. Последовательные реакции).
На показаны кинетические кривые для исходного, промежуточного и конечного веществ в последовательной реакции. Характерной особенностью этих кривых является наличие максимума у кривой промежуточного продукта и точки перегиба на кривой образования конечного продукта реакции. Однако эти особенности не могут служить однозначным признаком последовательной реакции. Известно много случаев, когда конечные продукты превращения ускоряют реакцию. Скорость таких автокаталитических процессов сначала возрастает вследствие увеличения количества продукта, являющегося катализатором, а затем уменьшается вследствие израсходования исходных веществ (см. Автокатализ). Реакция, идущая под влиянием другой, протекающей одновременно и в том же участке пространства, называется индуцированной, или сопряженной (см. Сопряженные реакции).
К цепных реакций. Реакции, в которых один первичный акт активации приводит к превращению большого числа молекул исходных веществ, называются цепными. В реакции зарождения цепи образуется активная частица — свободный радикал или Эта активная частица реагирует с молекулой исходного вещества, образуя молекулу продукта реакции и (вследствие неуничтожимости свободной валентности) регенерируя новую активную частицу; образовавшийся радикал в свою очередь реагирует с исходной молекулой и т.д. (неразветвленная цепь). Энергия активации взаимодействия радикалов и с молекулами не превышает 10 ккал/моль (41,86 кдж/моль), поэтому длина цепи из элементарных реакций достигает тысяч и сотен тысяч звеньев. В некоторых цепных реакциях увеличивается число свободных валентностей, что приводит к появлению новых активных центров, то есть новых цепей. Таким образом, цепь разветвляется и реакция ускоряется (становится нестационарной).
Цепь обрывается в результате соединения (рекомбинации) двух радикалов, в случае реакции радикала с некоторыми примесными частицами, соударения со стенкой сосуда. Скорость неразветвленной цепной реакции вначале растет, затем достигает постоянного значения и, наконец, медленно убывает. Скорость разветвленной цепной реакции возрастает со временем и при благоприятных условиях может произойти воспламенение реагирующей смеси. Достигнув максимального значения, скорость реакции уменьшается из-за расходования исходных веществ (подробнее см. Цепные реакции). В соответствии с этим кинетические кривые цепных разветвленных процессов имеют характерную -oбразную форму (). Точка перегиба на кривой отвечает максимуму скорости реакции.
Основы теории цепных реакций разработаны и экспериментально подтверждены в исследованиях советского ученого Н. Н. Семенова и его школы. В СССР успешно изучаются скорость и механизм важнейших групп цепных процессов: полимеризации, крекинга, окисления. На базе цепной теории окислительных реакций разработаны новые высокоэффективные технологические процессы получения важных продуктов (в частности, мономеров для получения полимеров) путем окисления нефтяного сырья и углеводородных газов. Цепная теория процессов ингибированного окисления позволяет предотвращать окислительную порчу (старение) полимеров, смазочных масел и бензинов, пищевых продуктов и лекарственных препаратов. Ингибиторы окисления, или стабилизаторы окислительных процессов (см. Ингибиторы химические), — это важнейшие представители малотоннажных продуктов органического синтеза.
К ионных реакций. Значительное число реакций в растворах протекает при участии ионов. Скорость ионных реакций сильно зависит от растворителей, так как в разных растворителях молекулы в разной степени диссоциированы на ионы. Энергия активации реакции ионов с молекулами невелика: заряд иона снижает энергию активации. При изучении кинетики реакций в растворах учитывают влияние полярных групп, наличие большого межмолекулярного взаимодействия, влияние растворителя и т.п.
К гетерогенных каталитических реакций. Для реакций газов и жидкостей, протекающих у поверхности твердых тел (см. Катализ), по-видимому, имеют место те же 3 основных типа превращений, которые были рассмотрены для гомогенных процессов, т. е. простые, радикально-цепные и ионные реакции. Различие заключается лишь в том, что в соответствующие кинетические уравнения входят концентрации реагирующих веществ в поверхностном адсорбционном слое (см. Адсорбция). Наблюдаются разные кинетические зависимости, которые обусловлены характером адсорбции исходных веществ и продуктов реакции на поверхности. Основной суммарный кинетический эффект катализатора заключается в снижении энергии активации реакции. Важной проблемой в области гетерогенного катализа является предвидение каталитического действия. Представления и методы, свойственные теории гетерогенного катализа, все больше сближаются с областью гомогенного катализа жидкофазных реакций, особенно при использовании в качестве катализаторов комплексных соединений переходных металлов. Выясняется механизм действия биологических катализаторов (ферментов), особенно с целью создания принципиально новых высокоэффективных катализаторов для реакций.
Советскими и зарубежными учеными успешно разрабатываются и многие другие актуальные проблемы К например, применение квантовой механики к анализу элементарного акта реакции; установление связей между строением веществ и кинетическими параметрами, характеризующими их реакционную способность; изучение кинетики и механизма конкретных сложных реакций с применением новейших физических экспериментальных методов и современной вычислительной техники; использование кинетических констант в инженерных расчетах в и нефтехимической промышленности.
Лит.: Семенов Н. Н., О некоторых проблемах кинетики и реакционной способности, 2 изд., М., 1958; Кондратьев В. Н., К газовых реакций, М., 1958; Эмануэль Н. М., Кнорре Д. Г., Курс кинетики, 2 изд., М., 1969; Бенсон С., Основы кинетики, пер. С англ., М., 1964: Эмануэль Н. М., кинетика, в сборнике: Развитие физической химии в СССР, М., 1967.
Н. М. Эмануэль. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:57:31
|

|

|
 |
|

|
 |
 |
 |
|