
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Кадмий | (далее К)(Cadmium), , элемент группы периодической системы номер 48, масса 112,40; белый, блестящий, тяжелый, мягкий, тягучий металл. Элемент состоит из смеси 8 стабильных изотопов с массовыми числами: 106 (1,215%), 108 (0,875%), 110 (12,39%), 111 (12,75%), 112 (24,07%), 113 (12,26%), 114 (28,86%), 116 (7,58%).
Историческая справка. В 1817 нем. химик Ф. Штромейер, при ревизии одной из аптек, обнаружил, что имевшийся там карбонат содержит примесь неизвестного металла, который осаждается в виде желтого сульфида сероводородом из кислого раствора. Штромейер назвал открытый им металл (от греч. kadméia - нечистая окись также руда). Независимо от него нем. ученые К Герман, К Карстен и В. Мейснер в 1818 открыли К в силезских рудах.
Распространение в природе. К - редкий и рассеянный элемент с кларком литосферы 1,3×10-5 % по массе. Для К характерны миграция в горячих подземных водах вместе с цинком и др. халькофильными элементами и концентрация в гидротермальных месторождениях. Минерал сфелерит местами содержит до 0,5-1% , максимально до 5%. Реже встречается гринокит . Концентрируется в морских осадочных породах - сланцах (Мансфельд, ГДР), в песчаниках, в которых он также связан с и др. халькофильными элементами. В биосфере известны 3 очень редких самостоятельных минерала К - карбонат 3 (отавит), окись (монтепонит) и .
Физические и свойства. решетка К гексагональная, а = 2,97311 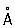 , с = 5,60694 , с = 5,60694 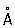 (при 25 °С); радиус 1,56 (при 25 °С); радиус 1,56 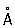 , ионный радиус 2+ 1,03 , ионный радиус 2+ 1,03 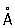 . Плотность 8,65 г/см3 (20 °С), tпл 320,9° С, tkип 767 °С, коэффициент термического расширения 29,8×10-6 (при 25 °С); теплопроводность (при 0 °) 97,55 вт/(м×К) или 0.233 кал/(см×сек°С); удельная теплоемкость (при 25 °С) 225,02 дж/(кг×К) или 0,055 кал/(г×°С); удельное электросопротивление (при 20°) 7,4×10-8ом×м (7,4×10-6 ом×см); температурный коэффициент электросопротивления 4,3×10-3 (0-100 °С). Предел прочности при растяжении 64 Мн/м2(6,4 кгс/мм2), относительное удлинение 20%, твердость по Бринеллю 160 Мн/м2 (16 кгс/мм2). . Плотность 8,65 г/см3 (20 °С), tпл 320,9° С, tkип 767 °С, коэффициент термического расширения 29,8×10-6 (при 25 °С); теплопроводность (при 0 °) 97,55 вт/(м×К) или 0.233 кал/(см×сек°С); удельная теплоемкость (при 25 °С) 225,02 дж/(кг×К) или 0,055 кал/(г×°С); удельное электросопротивление (при 20°) 7,4×10-8ом×м (7,4×10-6 ом×см); температурный коэффициент электросопротивления 4,3×10-3 (0-100 °С). Предел прочности при растяжении 64 Мн/м2(6,4 кгс/мм2), относительное удлинение 20%, твердость по Бринеллю 160 Мн/м2 (16 кгс/мм2).
В соответствии с внешней электронной конфигурацией 4d10 5s2 валентность К в соединениях равна 2 (впрочем, имеются указания на образование ионов 22+ при растворении К в расплавленном 2). На воздухе К тускнеет, покрываясь тонкой пленкой окиси , которая защищает металл от дальнейшего окисления. При сильном нагревании на воздухе К сгорает в окись - порошок от светло-коричневого до темно-бурого цвета, плотность 8,15 г/см3; при 700 °С возгоняется, не плавясь. К непосредственно соединяется с галогенами; эти соединения бесцветны; 2, 2 и Cdl2 очень легко растворимы в воде (около 1 ч. безводной соли в 1 ч. воды при 20 °С), 2 растворим труднее (1 ч. в 25 ч. воды). С серой К образует сульфид от лимонно-желтого до оранжево-красного цвета, нерастворимый в воде и разбавленных кислотах. К легко растворяется в кислоте с выделением окислов и образованием нитрата, который дает гидрат (3)2×42. Из кислот - соляной и разбавленной серной К медленно выделяет при выпаривании растворов из них гидраты 22×52 и сульфата 34×82. Растворы солей К имеют кислую реакцию вследствие гидролиза; едкие щелочи осаждают из них белую гидроокись ()2, нерастворимую в избытке реактива; впрочем, при действии концентриров. растворов щелочи на ()2 были получены гидрооксокадмиаты, например 2( ()). Катион 2+ легко образует комплексные ионы с аммиаком ( (3)4)2+ и с цианом ( ()4)2- и ( ()6)4-. Известны многочисленные основные, двойные и комплексные соли К Соединения К ядовиты; особенно опасно вдыхание паров его окиси.
Получение и применение. К получают из побочных продуктов переработки и руд. Эти продукты (содержащие 0,2-7% К обрабатывают разбавленной серной кислотой, которая растворяет окиси К и Из раствора осаждают К пылью; губчатый остаток (смесь К и растворяют в разбавленной серной кислоте и выделяют К электролизом этого раствора. Электролитический К переплавляют под слоем едкого натра и отливают в палочки; чистота металла - не менее 99,98%.
Металлический К применяют в ядерных реакторах, для антикоррозионных и декоративных покрытий (см. Кадмирование), в аккумуляторах. К служит основой некоторых подшипниковых сплавов, входит в состав легкоплавких сплавов (см., например, Вуда сплав). Легкоплавкие сплавы применяют для спайки стекла с металлом, в автоматических огнетушителях, для тонких и сложных отливок в гипсовых формах и др. Сульфид К ( желтая) - краска для живописи. Сульфат и амальгама К используются в нормальном элементе Вестона.
К в организме. Содержание К в растениях составляет 10-4% (на сухое вещество); у некоторых животных (губок, кишечнополостных, червей, иглокожих и оболочников) - 4×10-5-3×10-3% сухого вещества. Обнаружен у всех позвоночных животных. Наиболее богата К печень. Физиологическое значение К изучено недостаточно, но известно, что К влияет на углеводный обмен, на синтез в печени гиппуровой кислоты, на активность некоторых ферментов.
Лит.: Погодин С. А., в кн.: Краткая энциклопедия, т. 2, М., 1963; Реми Г., Курс неорганической химии, (пер. с нем.), т. 2, М., 1966, с, 476-486.
С. А. Погодин. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 21:02:54
|

|

|
 |
|

|
 |
 |
 |
|