
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Иод | Иод (далее И) (лат. Iodum), , элемент группы периодической системы относится к галогенам (в литературе встречается также символ J); номер 53, масса 126,9045; черно-серого цвета с металлическим блеском. Природный И состоит из одного стабильного изотопа с массовым числом 127. И открыл в 1811 французский химик Б. Куртуа. Нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой, он наблюдал выделение фиолетового пара (отсюда назв. И - от греч. iódes, ioeidés - похожий цветом на фиалку, фиолетовый), который конденсировался в виде темных блестящих пластинчатых В 1813-1814 французский химик Ж. Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную природу И
Распространение в природе. Среднее содержание И в земной коре 4×10-5% по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах и др.) соединения И рассеяны; глубинные минералы И неизвестны. История И в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками и др.). Известны 8 гипергенных минералов И, образующихся в биосфере, однако они очень редки. Основным резервуаром И для биосферы служит Мировой океан (в 1 л в среднем содержится 5×10-5 г И). Из океана соединения И, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. (Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены И) И легко адсорбируется органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений И переходит в подземные воды. Так образуются используемые для добычи И иодо- воды, особенно характерные для районов нефтяных месторождений (местами 1 л этих вод содержит свыше 100 мг И).
Физические и свойства. Плотность И 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °. Молекула жидкого и газообразного И состоит из двух (2). Заметная диссоциация
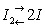
наблюдается выше 700°С, а также при действии света. Уже при обычной температуре И испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании И возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки И в лабораториях и в промышленности. И плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте и др.), а также в водных растворах иодидов.
Конфигурация внешних электронов атома И 52s 55p. В соответствии с этим И проявляет в соединениях переменную валентность (степень окисления): - 1 (в , , см. Иистый водород, Ииды), + 1 (в , , см. Иноватистая кислота), + 3 (в 3, см. Межгалогенные соединения), + 5 (в 3, 3, см. Иноватая кислота) и + 7 (в 4, 4, см. Иная кислота). И довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами И при легком нагревании энергично взаимодействует, образуя иодиды ( + 2 = 2). С И реагирует только при нагревании и не полностью, образуя иодистый С И непосредственно не соединяется. Элементарный И - окислитель, менее сильный, чем и Сероводород 2, тиосульфат 223 и др. восстановители восстанавливают его до -(2 + 2 = + 2). и другие сильные окислители в водных растворах переводят его в 3-(52 + 2 + 62 = 23 + 10). При растворении в воде И частично реагирует с ней
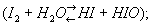
в горячих водных растворах щелочей образуются иодид и иодат (32 + 6 = 5 + 3 + 32). Адсорбируясь на крахмале, И окрашивает его в темно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения И
Пары И ядовиты и раздражают слизистые оболочки. На кожу И оказывает прижигающее и обеззараживающее действие. Пятна от И смывают растворами соды или тиосульфата
Получение и применение. Сырьем для промышленного получения И в СССР служат нефтяные буровые воды; за рубежом - морские водоросли, а также маточные растворы чилийской ( селитры, содержащие до 0,4% И в виде иодата Для извлечения И из нефтяных вод (содержащих обычно 20-40 мг/л И в виде иодилов) на них сначала действуют (2 + 2 = 2 + 2) или кислотой (2 + 22 + 224 = 224 + 2 + 2 + 22). Выделившийся И либо адсорбируют активным углем, либо выдувают воздухом. На И, адсорбированный углем, действуют едкой щелочью или сульфитом (2 + 23 + 2 = 24 + 2). Из продуктов реакции свободный И выделяют действием или серной кислоты и окислителя, например дихромата (227 + 724 + 6 = 24 + 324 + 2(4)3 + 32). При выдувании воздухом И поглощают смесью двуокиси серы с водяным паром (22 + 2 + 2 = = 24 + 2) и затем вытесняют И (2 + 2 = 2 + 2). Сырой И очищают возгонкой.
И и его соединения применяют главным образом в медицине и в аналитической химии (см. Иометрия), а также в органическом синтезе и фотографии. В промышленности применение И пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов (см. Иидный метод).
Лит.: Ксензенко В. И, Стасиневич Д. С., Технология и иода, М., 1960; Позин М. Е., Технология минеральных солей, 3 изд., Л., 1970, гл. 8; Ролстен Р. Ф., Иидные металлы и иодиды металлов, пер. с англ., М., 1968.
Д. С. Стасиневич.
И в организме. И - необходимый для животных и человека микроэлемент. В почвах и растениях таежно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон И содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Со, , ); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание И в почвах около 3×10-4%, в растениях около 2×10-5 %. В поверхностных питьевых водах И мало (от 10-7 до 10-9%). В приморских областях количество И в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных - составляет 1 или даже 0,2 мкг.
Поглощение И растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы И), например морские водоросли - фукус, ламинария, филлофора, накапливают до 1% И, некоторые губки - до 8,5% (в скелетном веществе спонгине). Водоросли, концентрирующие И, используются для его промышленного получения. В животный организм И поступает с пищей, водой, воздухом. Основной источник И - растительные продукты и корма. Всасывание И происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг И, в том числе в мышцах около 10-25 мг, в щитовидной в норме 6-15 мг. С помощью радиоактивного И (131 и 125) показано, что в щитовидной И накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них дииод- и моноиодтирозинов, которые конденсируются в гормон тетраиодтиронин (тироксин). Выделяется И из организма преимущественно через почки (до 70-80% ), молочные, слюнные и потовые частично с желчью.
В различных биогеохимических провинциях содержание И в суточном рационе колеблется (для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в И зависит от его физиологического состояния, времени года, температуры, адаптации организма к содержанию И в среде. Суточная потребность в И человека и животных - около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении). Введение в организм И повышает основной обмен, усиливает окислительные процессы, тонизирует мышцы, стимулирует половую функцию.
В связи с большим или меньшим недостатком И в пище и воде применяют иодирование поваренной соли, содержащей обычно 10-25 г иодистого на 1 т соли. Применение удобрений, содержащих И, может удвоить и утроить его содержание в с.-х. культурах.
Лит.: Гутбертсон Д. П., Микроэлементы, в кн.: Новое в физиологии домашних животных, пер. с англ., т. 1, М.-Л., 1958; Туракулов Я. Х., Биохимия и патохимия щитовидной Таш., 1963; Берзин Т., Биохимия гормонов, пер. с нем., М., 1964; Рапопорт С. М., Медицинская биохимия, пер. с нем., М., 1966.
В. В. Ковальский.
И в медицине. Препараты, содержащие И, обладают антибактериальными и противогрибковыми свойствами, она оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приеме внутрь препараты И оказывают влияние на обмен веществ, усиливают функцию щитовидной Малые дозы И (микроиод) тормозят функцию щитовидной действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку И влияет на и жировой (липидный) обмен, он нашел применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови.
Для диагностических целей используют рентгеноконтрастные вещества, содержащие И
При длительном применении препаратов И и при повышенной чувствительности к ним возможно появление иодизма - насморк, крапивница, отек Квинке, слюно- и слезотечение, угревидная сыпь (иододерма) и пр. Препараты И нельзя принимать при туберкулезе легких, беременности, при заболеваниях почек, хронической пиодермии, геморрагических диатезах, крапивнице.
И радиоактивный. Искусственно радиоактивные изотопы И - 125, 131, 132, и др. широко используются в биологии и особенно в медицине для определения функционального состояния щитовидной и лечения ряда ее заболеваний. Применение радиоактивного И в диагностике связано со способностью И избирательно накапливаться в щитовидной использование в лечебных целях основано на способности b-излучения радиоизотопов И разрушать секреторные клетки При загрязнениях окружающей среды продуктами ядерного деления радиоактивные изотопы И быстро включаются в биологический круговорот, попадая, в конечном счете, в молоко и, следовательно, в организм человека. Особенно опасно их проникновение в организм детей, щитовидная которых в 10 раз меньше, чем у взрослых людей, и к тому же обладает большей радиочувствительностью. С целью уменьшения отложения радиоактивных изотопов И в щитовидной рекомендуется применять препараты стабильного И (по 100-200 мг на прием). Радиоактивный И быстро и полностью всасывается в желудочно-кишечном тракте и избирательно откладывается в щитовидной Его поглощение зависит от функционального состояния Относительно высокие концентрации радиоизотопов И обнаруживаются также в слюнных и молочной и слизистой желудочно-кишечного тракта. Не поглощенный щитовидной радиоактивный И почти полностью и сравнительно быстро выделяется с мочой.
Ю. И Москалев. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 22:42:54
|

|

|
 |
|

|
 |
 |
 |
|