
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Инертные газы | Инертные газы (далее И) благородные газы, редкие газы, элементы, образующие главную подгруппу 8-й группы периодической системы гелий Не ( номер 2), неон (10), аргон (18), криптон (36), ксенон (54) и радон (86). Из всех И только не имеет стабильных изотопов и представляет собой радиоактивный элемент.
Название И отражает инертность элементов этой подгруппы, что объясняется наличием у И устойчивой внешней электронной оболочки, на которой у Не находится 2 электрона, а у остальных И по 8 электронов. Удаление электронов с такой оболочки требует больших затрат энергии в соответствии с высокими потенциалами ионизации И (см. таблицу).
Из-за инертности И долгое время не удавалось обнаружить, и они были открыты только во 2-й половине 19 в. К открытию первого И - - привело проведенное в 1868 французом Ж. Жансеном и англичанином Н. Локьером спектроскопическое исследование солнечных протуберанцев. Остальные И были открыты в 1892-1908.
И постоянно присутствуют в свободном виде в воздухе. 1 м3 воздуха при нормальных условиях содержит около 9,4 л И, главным образом (см. таблицу). Кроме воздуха, И присутствуют в растворенном виде в воде, содержатся в некоторых минералах и горных породах. входит в состав подземных газов и газов минеральных источников. Остальные стабильные И получают из воздуха в процессе его разделения. Источником служат радиоактивные препараты радия и др. После использования стабильные И вновь возвращаются в атмосферу и поэтому их запасы (кроме легкого Не, который постепенно рассеивается из атмосферы в космическом пространстве) не уменьшаются.
Молекулы И одноатомны. Все И не имеют цвета, запаха и вкуса; бесцветны они в твердом и жидком состоянии. Наличие заполненной внешней электронной оболочки обусловливает не только высокую инертность И, но и трудности получения их в жидком и твердом состояниях (см. таблицу). Другие физические свойства И см. в статьях об отдельных элементах.
Эле-мент
|
масса
|
Содер-жание в воздухе, об. %
|
радиусы,
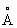
|
Первые потенциалы ионизации, в
|
При 1 атм. (~100 кн/м2)
|
по А. Бонди
|
по В. И. Лебедеву
|
tпл, °С
|
tкип, °С
|
Не
|
4,0026
|
4,6·10-4
|
1,40
|
0,291
|
24,58
|
-272,6*
|
-268,93
|
|
20,179
|
1,61·10-3
|
1,54
|
0,350
|
21,56
|
-248,6
|
-245,9
|
|
39,948
|
0,9325
|
1,88
|
0,690
|
15,76
|
-189,3
|
-185,9
|
|
83,80
|
1,08·10-4
|
2,02
|
0,795
|
14,00
|
-157,1
|
-153,2
|
|
131,30
|
8·10-6
|
2,16
|
0,986
|
12,13
|
-111,8
|
-108,1
|
|
222
|
6·10-18
|
-
|
1,096
|
10,75
|
около -71
|
около -63
|
*При 26 атм. (~2,6 Мн/м2). Массовое число наиболее долгоживущего изотопа.
Долгое время попытки получить соединения И оканчивались неудачей. Положить конец представлениям об абсолютной недеятельности И удалось канадскому ученому Н. Бартлетту, который в 1962 сообщил о синтезе соединения с 6. В последующие годы было получено большое число соединений , и , в которых И имеют степени окисления +1, +2, +4, +6 и +8. При этом существенно, что для объяснения строения этих соединений не потребовалось принципиально новых представлений о природе связи, и связь в соединениях И хорошо описывается, например, методом молекулярных орбиталей (см. Валентность, Молекулярных орбиталей метод). Из-за быстрого радиоактивного распада его соединения получены в ничтожно малых количествах и состав их установлен ориентировочно. Соединения значительно стабильнее соединений , а получить устойчивые соединения и более легких И пока не удалось. В большинстве реакций И участвует одни вещества получают, действуя на И или агентами (5, 6 и т. д.), другие образуются при разложении И Имеются указания на возможность протекания реакций и Кr с Получены также окислы (03, 04) и оксигалогениды И
Кроме указанных выше соединений, И образуют при низких температурах соединения включения. Так, все И, кроме Не, дают с водой типа Хе×6Н2О, с фенолом тяжелые И дают соединения типа Хе×3С6Н5ОН и т. д.
Промышленное использование И основано на их низкой активности или специфических физических свойствах. Примеры применения И см. в статьях об отдельных элементах.
Лит.: Финкельштейн Д. Н., И, М., 1961; Фастовский В. Г., Ровинский А. Е., Петровский Ю. В., И, М., 1964; Крамер Ф., Соединения включения, пер. с нем., М., 1958; Бердоносов С. С., И вчера и сегодня, М., 1966; Соединения благородных газов, пер. с англ., М., 1965; Коттон Ф., Уилкинсон Дж., Современная неорганическая пер. с англ., ч. 2, М., 1969; Дяткина М. Е., Электронное строение соединений инертных газов, "Журнал структурной химии", 1969, т. 10, № 1, с. 164.
С. С. Бердоносов. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:56:00
|

|

|
 |
|

|
 |
 |
 |
|