
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Индий | (далее И)(лат. Indium), , элемент группы периодической системы номер 49, масса 114,82; белый блестящий мягкий металл. Элемент состоит из смеси двух изотопов: 113 (4,33%) и 115 (95,67%); последний изотоп обладает очень слабой b-радиоактивностью (период полураспада T1/2 = 6×1014 лет).
В 1863 немецкие ученые Ф. Райх и Т. Рихтер при спектроскопическом исследовании обманки обнаружили в спектре новые линии, принадлежащие неизвестному элементу. По ярко-синей (цвета индиго) окраске этих линий новый элемент был назван И
Распространение в природе. И - типичный рассеянный элемент, его среднее содержание в литосфере составляет 1,4×10-5% по массе. При магматических процессах происходит слабое накопление И в гранитах и других кислых породах. Главные процессы концентрации И в земной коре связаны с горячими водными растворами, образующими гидротермальные месторождения. И связан в них с , , и . Сфалериты, халькопириты и касситериты обогащены И в среднем в 100 раз (содержание около 1,4×10-3%). Известны 3 минерала И - самородный И рокезит 2 и индит 24, но все они крайне редкие. Практическое значение имеет накопление И в сфалеритах (до 0,1%, иногда 1% ).
Обогащение И характерно для месторождений Тихоокеанского рудного пояса.
Физические и свойства. решетка И тетрагональная гранецентрированная с параметрами а = 4,583 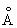 и с = 4,936 и с = 4,936 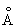 . радиус 1,66 . радиус 1,66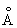 ; ионные радиусы 3+ 0,92 ; ионные радиусы 3+ 0,92 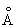 , + 1,30 , + 1,30 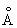 ; плотность 7,362 г/см3. И легкоплавок, его tпл 156,2 °С; tkип 2075 °С. Температурный коэффициент линейного расширения 33×10-6 (20 °С); удельная теплоемкость при 0-150 °С 234,461 дж/(кг·К), или 0,056 кал/(г·°С); удельное электросопротивление при 0°С 8,2×10-8 ом×м, или 8,2×10-6 ом×см, модуль упругости 11 Гн/м2, или 1100 кгс/мм2; твердость по Бринеллю 9 Мн/м2, или 0,9 кгс/мм2. ; плотность 7,362 г/см3. И легкоплавок, его tпл 156,2 °С; tkип 2075 °С. Температурный коэффициент линейного расширения 33×10-6 (20 °С); удельная теплоемкость при 0-150 °С 234,461 дж/(кг·К), или 0,056 кал/(г·°С); удельное электросопротивление при 0°С 8,2×10-8 ом×м, или 8,2×10-6 ом×см, модуль упругости 11 Гн/м2, или 1100 кгс/мм2; твердость по Бринеллю 9 Мн/м2, или 0,9 кгс/мм2.
В соответствии с электронной конфигурацией атома 4d105s25p1 И в соединениях проявляет валентность 1, 2 и 3 (преимущественно). На воздухе в твердом компактном состоянии И стоек, но окисляется при высоких температурах, а выше 800 °С горит фиолетово-синим пламенем, давая окись 23 - желтые хорошо растворимые в кислотах. При нагревании И легко соединяется с галогенами, образуя растворимые галогениды 3, 3, 3. Нагреванием И в токе получают 2, а при пропускании паров 2 над нагретым образуется . С серой И образует сульфиды 23, ; они дают соединения ×23 и 3×23. В воде в присутствии окислителей И медленно корродирует с поверхности: 4 + 32+62 = 4()3. В кислотах И растворим, его нормальный электродный потенциал равен - 0,34 в, в щелочах практически не растворяется. Соли И легко гидролизуются; продукт гидролиза - основные соли или гидроокись ()3. Последняя хорошо растворима в кислотах и плохо - в растворах щелочей (с образованием солей - индатов): ()3 + 3 = 3(()6). Соединения И низших степеней окисления довольно неустойчивы; галогениды InHal и черный окисел 2 - очень сильные восстановители.
Получение и применение. И получают из отходов и промежуточных продуктов производства и Это сырье содержит от тысячных до десятых долей процента И Извлечение И складывается из трех основных этапов: получение обогащенного продукта - концентрата И переработка концентрата до чернового металла; рафинирование. В большинстве случаев исходное сырье обрабатывают серной кислотой и переводят И в раствор, из которого гидролитическим осаждением выделяют концентрат. Черновой И выделяют главным образом цементацией на или Рафинирование производят электрохимическими, дистилляционными и методами. Наиболее широко И и его соединения (например, нитрид , фосфид , антимонид ) применяют в полупроводниковой технике (см. Полупроводниковые материалы). И служит для различных антикоррозионных покрытий (в том числе подшипниковых). покрытия обладают высокой отражательной способностью, что используется для изготовления зеркал и рефлекторов. Промышленное значение имеют некоторые сплавы И в том числе легкоплавкие сплавы, припои для склеивания стекла с металлом и др.
Лит.: и технология редких и рассеянных элементов, под ред. К. А. Большакова, т. 1-2, М., 1965-69 (т. 1, с. 88-99, т. 2, с. 178-207); Зеликман А. Н., Крейн О. Е., Самсонов Г. В., Металлургия редких металлов, М., 1964, с. 424-45; Основы металлургии, под ред. Н. С. Грейвера, Н. П. Сажина, И А. Стригина, т. 4, М., 1967, с. 552-61.
Н. А. Гурович.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:49:43
|

|

|
 |
|

|
 |
 |
 |
|