
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Аммиак | Аммиак (далее А) 3, простейшее соединение с Один из важнейших продуктов промышленности; синтез А из воздуха и — основной метод получения т. н. связанного азота. В природе А образуется при разложении органических веществ. Название "А" — сокращенное от греч. hals ammoniakos или лат. sal ammoniacus; так назывался нашатырь (аммония хлорид), который получали в оазисе Аммониум (ныне Сива) в Ливийской пустыне.
Физические и свойства. А — бесцветный газ с резким удушливым запахом и едким вкусом. Плотность газообразного А при 0°С и 101,3 кн/м2 (760 мм рт. ст.) 0,7714 кг/м3, tкип —33,35°С, tпл —77,70°С, tкpит 132,4°С, давление критическое 11,28 Мн/м2 (115,0 кгс/см2), плотность критическая 235 кг/м3, теплота испарения 23,37 кдж/моль (5,581 ккал/моль). Сухая смесь А с воздухом способна взрываться; границы взрывчатости при комнатной температуре лежат в пределах 15,5—28% А, с повышением температуры границы расширяются. А хорошо растворим в воде (при 0°С объем воды поглощает около 1200 объемов А, при 20 °С — около 700 объемов А). При 20°С и 0,87 Мн/м2 (8,9 кгс/см2) А легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет. Подобно воде, жидкий А сильно ассоциирован, главным образом за счет образования водородных связей. Жидкий А практически не проводит электрический ток. Жидкий А — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твердый А — бесцветные кубические
Молекула А имеет форму правильной тригонометрической пирамиды с в вершине; углы между связями —— 108°, межатомные расстояния —— 1,015 , — 1,64 , — 1,64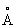 . .
Интересным свойством молекул А является их способность к структурной инверсии, т. е. к "выворачиванию наизнанку" путем прохождения сквозь образованную плоскость основания пирамиды. Инверсия связана с излучением строго определенной частоты, на основе чего была создана аппаратура для очень точного определения времени (молекулярные генераторы). Такие "молекулярные часы" позволили, в частности, установить, что продолжительность земных суток ежегодно возрастает на 0,43 мсек. Дипольный момент молекулы А равен 1,43D. Благодаря отсутствию неспаренных электронов А диамагнитен.
А — весьма реакционноспособное соединение. За счет наличия неподеленной электронной пары у особенно характерны и легко осуществимы для А реакции присоединения. Наиболее важна реакция присоединения протона к молекуле А, ведущая к образованию иона аммония +4, который в соединениях с анионами кислот ведет себя подобно ионам щелочных металлов. Такие реакции происходят при растворении А в воде с образованием слабого основания — аммония гидроокиси 4, а также при непосредственном взаимодействии А с кислотами. Распространенный тип реакций присоединения — образование аммиакатов при действии газообразного или жидкого А на соли. Для А характерны также реакции замещения. Щелочные и щелочноземельные металлы реагируют с жидким и газообразным А, образуя в зависимости от условий нитриды (3) или амиды (2). А реагирует также с серой, галогенами, углем, 2 и др. К окислителям в обычных условиях А довольно устойчив, однако, будучи подожжен, он горит в атмосфере образуя воду и свободный Каталитическим окислением А получают окись превращаемую затем в азотную кислоту.
Получение и применение. В лабораторных условиях А может быть получен вытеснением его сильными щелочами из аммониевых солей по схеме: 24 + ()2 = 23 + 2 + 22. Старейший промышленный способ получения А — выделение его из отходящих газов при коксовании угля. Основной современный способ промышленного получения А — синтез из элементов — и предложенный в 1908 немецким химиком Ф. Габером.
Наиболее распространенным и экономичным методом получения технологического газа для синтеза А является конверсия углеводородных газов. Исходным сырьем в этом процессе служит природный газ, а также попутные нефтяные газы, газы нефтепереработки, остаточные газы производства ацетилена. Сущность конверсионного метода получения смеси состоит в разложении при высокой температуре метана и его гомологов на и окись с помощью окислителей — водяного пара и К конвертированному газу при этом добавляют атмосферный воздух или воздух, обогащенный Синтез А из простых веществ
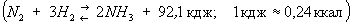
протекает с выделением тепла и уменьшением объема. Наиболее благоприятными, с точки зрения равновесия, условиями образования А являются возможно более низкая температура и возможно более высокое давление. Без катализаторов реакция синтеза А вообще не происходит. В промышленности для синтеза А используют исключительно катализаторы, получаемые восстановлением сплавленных окислов 34 с активаторами (23, 2, , 2, а иногда и ). Важный этап процесса синтеза — очистка газовой смеси от каталитических ядов (к ним относятся вещества, содержащие , 2, , , , пары воды, и др.).
Способы производства синтетического А различаются по применяемому давлению: системы низкого (10—15 Мн/м2), среднего (25—30 Мн/м2) и высокого (50—100 Мк/л2) давления. Наиболее распространены системы среднего давления (30 Мн/м2 и 500°С) (1 Мн/м2(10 кгс/см2). Для увеличения степени использования газа в современных системах синтеза А применяют многократную циркуляцию смеси — круговой аммиачный цикл (см. рис.).
Свежий газ ( смесь) и непрореагировавшие, т. н. циркуляционные газы поступают сначала в фильтр 1, где они очищаются от посторонних примесей, затем в межтрубное пространство конденсационной колонны 2, отдавая свое тепло газу, движущемуся по трубкам колонны. Далее газы проходят через испаритель 3, в котором происходят их дальнейшее охлаждение и конденсация А, увлеченного циркуляционными газами. Охлажденная смесь газов и сконденсировавшийся А из испарителя направляются в разделительную часть (сепаратор) конденсационной колонны, где жидкий А отделяется и как готовый продукт выводится по трубе в резервуар 9. Газообразный А, выходящий из испарителя, проходя брызгоуловитель 4, освобождается от капель жидкого А и направляется в цех переработки или в холодильную установку на сжижение. Газы, освобожденные от А, из сепаратора поступают в колонну синтеза 5. Колонна синтеза внутри имеет катализаторную коробку с трубчатой или полочной насадкой и теплообменник. Газы, проходя через колонну синтеза, реагируют между собой; выходящая из колонны газовая смесь содержит 15 — 20% А Далее эти газы поступают в конденсатор 6, где и происходит сжижение А Жидкий А отделяется в сепараторе 7 и поступает в резервуар 9, а непрореагировавшие газы подаются циркуляционным насосом 8 в фильтр 1 для смешения со свежей смесью.
А используется для получения кислоты, солей, мочевины, синильной кислоты, соды по аммиачному методу. Так как жидкий А имеет большую теплоту испарения, то. он служит рабочим веществом холодильных машин. Жидкий А и его водные растворы применяют как жидкие удобрения. Большие количества А идут на аммонизацию суперфосфата и туковых смесей.
А ядовит. Он сильно раздражает слизистые оболочки. Острое отравление А вызывает поражения глаз и дыхательных путей, одышку, воспаление легких. Предельно допустимой концентрацией А в воздухе производственных помещений считается 0,02 г/м3. А хранят в стальных баллонах, окрашенных в желтый цвет, с черной надписью — А
Лит.: Технология связанного М., 1966.
В. К. Бельский.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 09.03.2026 22:27:20
|

|

|
 |
|

|
 |
 |
 |
|