
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Действующих масс закон | Действующих масс закон (далее Д) один из основных законов физической химии; устанавливает зависимость скорости реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии равновесия. Норвежские ученые К. Гульдберг и П. Вааге, сформулировавшие Д в 1864-67, назвали "действующей массой" вещества его количество в единице объема, т. е. концентрацию, отсюда - наименование закона.
Если в идеальной газовой смеси или идеальном жидком растворе происходит реакция:
аА + а"А" = b + b"" (1)
(А, А" и т.д. - вещества, а, а" и т.д. - стехиометрические коэффициенты), то, согласно Д, скорость реакции в прямом направлении:
r+ = k+ (A) a (A") a" (2)
Здесь (А) - концентрация вещества А и т.д., k+ - константа скорости реакции (в прямом направлении), k+ зависит от температуры, а в случае жидкого раствора - также и от давления; последняя зависимость существенна лишь при высоких давлениях. Вид уравнения (2) определяется тем, что необходимым условием элементарного акта реакции является столкновение молекул исходных веществ, т. е. их встреча в некотором малом объеме (порядка размера молекул). Вероятность найти в данный момент в данном малом объеме молекулу А пропорциональна (А); вероятность найти в нем одновременно а молекул А и а" молекул А" по теореме о вероятности сложного события пропорциональна (А) a (А") a". Число столкновений молекул исходных веществ в единичном объеме за единичное время пропорционально этой величине. Определенная доля этих столкновений приводит к реакции. Отсюда вытекает уравнение (2). Мономолекулярные реакции требуют особого рассмотрения.
Скорость реакции (1) в обратном направлении
r- = k- () b (") b". (3)
Если реакция обратима, т. е. протекает одновременно в противоположных направлениях, то наблюдаемая скорость реакции r = r+ - r-. При r+ = r- осуществляется равновесие. Тогда, согласно уравнениям (2) и (3),
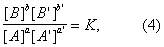
где К = k+/k- - константа равновесия. Для газовых реакций обычно применяют равноценное уравнение
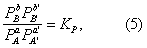
где A - парциальное давление вещества А и т.д.
Уравнения (2) и (3) применимы к простой (одностадийной) реакции и к отдельным стадиям сложной реакции, но не к сложной реакции в целом. Уравнения (4) и (5), выражающие Д для равновесия, справедливы и в случае сложной реакции.
Общим условием равновесия по отношению к реакции (1), приложимость которого не ограничена идеальными системами, является уравнение
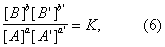
в котором (А) - активность вещества А и т.д. Уравнение (6) выводится из принципов термодинамики. С помощью Д для равновесия вычисляют максимально достижимые степени превращения при обратимых реакциях. В число последних входят важные промышленные процессы - синтез аммиака, окисление сернистого газа и многие другие. На основе Д для скоростей реакций получают кинетические уравнения, применяемые при расчете аппаратуры.
Лит. см. при ст. Кинетика химическая и Термодинамика химическая.
М. И. Темкин.< |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 23.02.2026 18:07:02
|

|

|
 |
|

|
 |
 |
 |
|