
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Гидратация | Гидратация (далее Г) (от греч. hydor - вода), процессы связывания воды веществами. Различают несколько видов Г
Г окислов приводит к гидроокисям, представляющим собой щелочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси дает гидроокись (в технике этот процесс называется "гашение извести"):
СаО + 2 = ()2.
Г серного ангидрида в промышленности чают серную кислоту, а окислов - кислоту:
2 + 2 = 24,
32 + 2 = 23 + .
При Г трехокиси образуется слабая кислота, имеющая амфотерные свойства:
23 + 32 = 233.
Г органических соединений происходит по кратным связям; в случае циклических соединений Г приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая Г). Г этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой Г олефинов получают спирты, например этиловый спирт из этилена:
2 = 2 + 2 ® 32.
Г ацетилена приводит к ацетальдегиду (реакция Кучерова) (промежуточный продукт - неустойчивый виниловый спирт):
º + 2 ® (СН2=СН-ОН) ® 3.
В результате Г кетена образуется уксусная кислота, а окиси этилена - этиленгликоль:
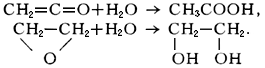
В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между и группой .
Многие неорганические и некоторые органические вещества образуют с водой твердые кристаллогидраты, постоянного состава, которые ведут себя как индивидуальные соединения. Так, безводный сульфат меди 4 бесцветен; из его водных растворов ярко-синий гидрат 4·52 - купорос, при нагревании которого образуется сначала голубой 4·32, затем 4·2 белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится Г молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами 2. При растворении электролитов происходит Г ионов, затрудняющая ассоциацию последних. Энергия Г в значительной степени компенсирует энергию диссоциации электролита; т. о., Г ионов является одной из главных причин электролитической диссоциации в водных растворах. Образование и Г молекул и ионов в растворах являются частными случаями сольватации, т. е. присоединения молекул растворителя. К Г относят также процессы, приводящие к связыванию воды за счет адсорбционных сил (см. Адсорбция). См. также Вода.
В биологических системах при Г происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при Г гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С Г связаны многие биологические процессы. Так, Г ионов влияет на их проникновение в клетку, а Г изменяет некоторые их свойства - в частности ферментативную активность.
Процесс, обратный Г, т. е. потеря связанной веществами воды, называется дегидратацией. Г и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:49:59
|

|

|
 |
|

|
 |
 |
 |
|