
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Гиббсова энергия | Гиббсова энергия (далее Г), энергия Гиббса, изобарный потенциал, одна из характеристических функций термодинамической системы, обозначается G, определяется через энтальпию , энтропию и температуру Т равенством
G = - TS. (1)
Г является потенциалом термодинамическим. В изотермическом равновесном процессе, происходящем при постоянном давлении, убыль Г данной системы равна полной работе, производимой системой в этом процессе, за вычетом работы против внешнего давления (т. е. равна максимальной полезной работе). Г выражается обычно в кдж/моль или в ккал/моль. С помощью Г и ее производных могут быть в простой форме выражены др. термодинамические функции и свойства системы (внутренняя энергия, энтальпия, химический потенциал и др.) в условиях постоянства температуры и давления. При этих условиях любой термодинамический процесс может протекать без затраты работы извне только в том направлении, которое отвечает уменьшению G (dG < 0). Пределом протекания его без затраты работы, т. е. условием равновесия, служит достижение минимального значения G (dG = 0, d2G > 0). Г широко используется при рассмотрении различных термодинамических процессов, проводимых при постоянных температуре и давлении. Через Г определяется работа обратимого намагничивания магнетика и поляризации диэлектрика в этих условиях. Знание Г важно для термодинамического рассмотрения фазовых переходов. Константа равновесия Ка реакции при любой температуре Т определяется через стандартное изменение Г DG° соотношением
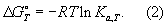
Широко используется Г 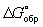 образования соединения, равная изменению Г в реакции образования данного соединения (или простого вещества) из стандартного состояния соответствующих простых веществ. Для любой реакции образования соединения, равная изменению Г в реакции образования данного соединения (или простого вещества) из стандартного состояния соответствующих простых веществ. Для любой реакции 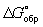 равна алгебраической сумме произведений равна алгебраической сумме произведений 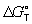 веществ, участвующих в реакции, на их коэффициенты в уравнении реакции. Для 298,15 К веществ, участвующих в реакции, на их коэффициенты в уравнении реакции. Для 298,15 К 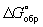 известны уже для нескольких тысяч веществ, что дает возможность расчетным путем определять соответствующие значения известны уже для нескольких тысяч веществ, что дает возможность расчетным путем определять соответствующие значения 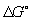 и Ка для большого числа реакций. и Ка для большого числа реакций.
Наряду с уравнением (1) Г может быть определена также через внутреннюю энергию , гельмгольцеву энергию А и произведение объема на давление р на основе равенств
G = - TS + pV, (3)
G = A + pV, (4)
Характеристическую функцию Г разные авторы долгое время называли по-разному: свободной энергией, свободной энергией при постоянном давлении, термодинамическим потенциалом, термодинамическим потенциалом Гиббса, изобарно-изотермическим потенциалом, свободной энтальпией и др.; для обозначения этой функции использовались различные символы (Z, , Ф). Принятые здесь термин "Г" и символ G отвечают решению 18-го конгресса Международного союза чистой и прикладной химии 1961.
В. А. Киреев. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 10.03.2026 01:35:32
|

|

|
 |
|

|
 |
 |
 |
|