
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Гафний | (далее Г)(лат. Hafnium), , элемент группы периодической системы порядковый номер 72, масса 178, 49; металл. В состав природного Г входят 6 стабильных изотопов с массовыми числами 174, 176—180. Существование Г было предсказано Д. И. в 1870. В 1921 Н. Бор показал, что элемент № 72 должен иметь строение подобное и что, следовательно, его надо искать не среди редкоземельных элементов, как думали раньше, а среди минералов Венгерский химик Д. Хевеши и голландский физик Д. Костер систематически исследовали минералы методом рентгеноспектрального анализа и в 1922 обнаружили элемент № 72, назвав его Г по месту открытия — городу Копенгагену (позднелат. Hafnia).
Г не имеет собственных минералов и в природе обычно сопутствует В земной коре содержится 3,2·10-4% Г по массе, в большинстве минералов его содержание составляет от 1—2 до 6—7%, во вторичных минералах — иногда до 35%. Наиболее ценным промышленным типом месторождений Г являются морские и аллювиальные россыпи минерала циркона (см. Цирконий).
Физические и свойства. При обычной температуре Г имеет гексагональную решетку с периодами а = 3,1946 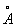 и с = 5,0511 и с = 5,0511 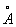 . Плотность Г 13,09 г/см3 (20 °С). Г тугоплавок, его tпл 2222 ± 30 °С, tkип 5400 °С. теплоемкость 26,3 кдж/(кг- (6,27 кал/(г- ´ град)) (25—100° С); удельное электросопротивление 32,4·10-8 ом·м (0°С). Особенность Г — высокая эмиссионная способность; работа выхода электрона 5,77 ´ 10-19 дж, или 3,60 эв (980—1550°С); Г имеет высокое сечение захвата тепловых нейтронов, равное 115·10-28 м2, или 115 барн (у 0,18·10-28 м2, или 0,18 барн). Чистый Г пластичен, легко поддается холодной и горячей обработке (прокатке, ковке, штамповке). . Плотность Г 13,09 г/см3 (20 °С). Г тугоплавок, его tпл 2222 ± 30 °С, tkип 5400 °С. теплоемкость 26,3 кдж/(кг- (6,27 кал/(г- ´ град)) (25—100° С); удельное электросопротивление 32,4·10-8 ом·м (0°С). Особенность Г — высокая эмиссионная способность; работа выхода электрона 5,77 ´ 10-19 дж, или 3,60 эв (980—1550°С); Г имеет высокое сечение захвата тепловых нейтронов, равное 115·10-28 м2, или 115 барн (у 0,18·10-28 м2, или 0,18 барн). Чистый Г пластичен, легко поддается холодной и горячей обработке (прокатке, ковке, штамповке).
По свойствам Г очень похож на вследствие почти одинаковых размеров ионов этих элементов и полного сходства электронной структуры. Однако активность Г несколько меньше, чем . Основная валентность Г равна 4. Известны также соединения 3-, 2- и 1-валентного Г
При комнатной температуре компактный Г совершенно устойчив к атмосферным газам. Однако при нагревании выше 600 °С быстро окисляется и взаимодействует, подобно с и Г отличается коррозионной стойкостью в чистой воде и водяных парах до температур 400 °С. Порошкообразный Г пирофорен. Двуокись Г 2 — белое тугоплавкое (плавится 2780 °С) вещество, обладающее высокой стойкостью. Двуокись Г и соответствующие ей гидроокиси (2·2 и ()2) амфотерны с преобладанием основных свойств. При нагревании 2 с щелочами и окислами щелочноземельных металлов образуются гафиаты, например Me23, Me44, Me225.
При нагревании Г реагирует с галогенами, образуя соединения типа HfX4 (тетрафторид 4, тетрахлорид 4 и др.). При высокой температуре Г взаимодействует с бором, образуя металлоподобные, тугоплавкие, весьма устойчивые по отношению к реагентам соединения: , 2 (tпл 3250 °С), (tпл 3887 °С), (tпл 3310 °С), 2. , 2. Металлический Г растворяется в плавиковой и концентрированной серной кислотах и расплавленных щелочных металлов. Он практически не растворим в соляной, и органических кислотах и весьма устойчив по отношению к растворам щелочей. К числу хорошо растворимых в воде соединений Г которые находят применение в технологии и аналитической химии Г принадлежат тетрахлорид и оксихлорид — 4 и 2·82, нитраты и сульфаты Г — (3)2·nH2 (n = 2 и 6), (4)2 и (4)2·42. Для Г характерно образование комплексов с различными органическими соединениями.
Получение и применение. Соединения Г обычно выделяют в конце технологического цикла производства соединений из рудного сырья. Металлический Г в настоящее время получают восстановлением 4 или Г начал применяться в различных областях техники лишь недавно. Он используется в ядерной энергетике (регулирующие стержни реакторов, экраны для защиты от нейтронного излучения) и в электронной технике (катоды, геттеры, электроконтакты). Перспективно применение Г в производстве жаропрочных сплавов для авиации и ракетной техники. Твердый раствор карбидов Г и плавящийся выше 4000 °С, — самый тугоплавкий керамический материал; из него изготовляют тигли для плавки тугоплавких металлов, детали реактивных двигателей.
Лит.: Металлургия под ред. Д. Е. Томаса и Е. Т. Хейса, пер. с англ., М., 1967; Справочник по редким металлам, пер. с англ., М., 1965, с. 177—203.
Л. Н. Комиссарова. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 10.03.2026 00:12:16
|

|

|
 |
|

|
 |
 |
 |
|