
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Вода | Вода (далее В) окись 20, простейшее устойчивое в обычных условиях соединение с (11,19% и 88,81% по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях имеет голубоватый цвет), В принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической и среды, климата и погоды на нашей планете. Без В невозможно существование живых организмов. В - обязательный компонент практически всех технологических процессов - как сельскохозяйственного, так и промышленного производства.
В в природе. В широко распространена в природе. Гидросфера - водная оболочка Земли, включающая океаны, моря, озера, водохранилища, реки, подземные В, почвенную влагу, составляет около 1,4-1,5 млрд. км3, причем на долю В суши приходится всего около 90 млн. км3. Из них подземные воды составляют 60, ледники 29, озера 0,75, почвенная влага 0,075, реки 0,0012 млн. км3. В атмосфере В находится в виде пара, тумана и облаков, капель дождя и снега (всего около 13-15 тыс. км3). Около 10% поверхности суши постоянно занимают ледники. На севере и северо-востоке СССР, на Аляске и Севере Канады - общей площадью около 16 млн. км2 всегда сохраняется подпочвенный слой льда (всего около 0,5 млн. км3. В земной коре - литосфере содержится, по разным оценкам, от 1 до 1,3 млрд. км3 В, что близко к содержанию ее в гидросфере. В земной коре значительные количества В находятся в связанном состоянии, входя в состав некоторых минералов и горных пород (гипс, гидратированные формы кремнезема, гидросиликаты и др.). Огромные количества В (13-15 млрд. км3) сосредоточены в более глубоких недрах мантии Земли. Выход В, выделявшейся из мантии в процессе разогревания Земли на ранних стадиях ее формирования, и дал, по современным воззрениям, начало гидросфере. Ежегодное поступление В из мантии и магматических очагов составляет около 1 км3. Имеются данные о том, что В, хотя бы частично, имеет "космическое" происхождение: протоны, пришедшие в верхнюю атмосферу от Солнца, захватив электроны, превращаются в которые, соединяясь с дают 2. В входит в состав всех живых организмов, причем в целом в них содержится лишь вдвое меньше В, чем во всех реках Земли. В живых организмах количество В, за исключением семян и спор, колеблется между 60 и 99,7% по массе. По словам французского биолога Э. Дюбуа-Реймона, живой организм есть l"eau animée (одушевленная вода). Все воды Земли постоянно взаимодействуют между собой, а также с атмосферой, литосферой и биосферой (см. Влагооборот, Водный баланс)/
В в природных условиях всегда содержит растворенные соли, газы и органические вещества. Их количественный состав меняется в зависимости от происхождения В и окружающих условий. При концентрации солей до 1 г/кг В считают пресной, до 25 г/кг - солоноватой, свыше - соленой.
Наименее минерализованными В являются атмосферные осадки (в среднем около 10-20 мг/кг), затем пресные озера и реки (50-1000 мг/кг). Соленость океана колеблется около 35 г/кг; моря имеют меньшую минерализацию (Черное 17-22 г/кг; Балтийское 8-16 г/кг; Каспийское 11-13 г/кг). Минерализация подземных В вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг, в глубинных артезианских В минерализация колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озерах (до 300 г/кг) и глубокозалегающих подземных В (до 600 г/кг).
В пресных В обычно преобладают ионы 3-, Са2+ и 2+. По мере увеличения общей минерализации растет концентрация ионов 42-, -, + и К+. В высо-коминерализованных В преобладают ионы - и +, реже 2+ и очень редко 2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных В
Из растворенных газов в природных В присутствуют двуокись благородные газы, редко сероводород и углеводороды. Концентрация органических веществ невелика - в среднем в реках около 20 мг/л, в подземных В еще меньше, в океане около 4 мг/л. Исключение составляют В болотные и нефтяных месторождений и В, загрязненные промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих В, и соединения, образующиеся при распаде их остатков.
Первоисточниками солей природных В являются вещества, образующиеся при выветривании изверженных пород (2+, 2+, +, К+ и др.), и вещества, выделявшиеся на протяжении всей истории Земли из ее недр (2, 2, , 3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с В, зависит состав В Громадное значение для состава В имеет и воздействие живых организмов (см. также Гидрохимия).
Изотопный состав В В связи с существованием двух стабильных изотопов у водорода (1 и 2, обычно обозначаемые Н и D) и трех у (16,17 и 18) известно 9 изотопных разновидностей В, которые находятся в природной В в среднем в следующих соотношениях (в молярных %): 99,73 216; 0,04 217; 0,20 218, 0,03 HD`16, а также 10-5-10-15%(суммарно) HD17, HD18, D216, D217, D218. Особый интерес представляет тяжелая вода D2, содержащая дейтерий. В В Земли находится всего13-20 кг "сверхтяжелой" В. содержащей радиоактивный изотоп - тритий (3, или Т).
Историческая справка. Благодаря широкой распространенности В и ее роли в жизни людей, она издавна считалась первоисточником жизни. Представление философов античности о В как о начале всех вещей нашло отражение в учении Аристотеля (4 в. до н. э.) о четырех стихиях (огне, воздухе, земле и В), причем В считалась носителем холода и влажности. Вплоть до конца 18 в. в науке существовало представление о В как об индивидуальном элементе. В 1781-82 английский ученый Г. Кавендиш впервые синтезировал В, взрывая электрической искрой смесь и а в 1783 французский ученый А. Лавуазье, повторив эти опыты, впервые сделал правильный вывод, что В есть соединение и В 1785 Лавуазье совместно с французским ученым Ж. Менье определил количественный состав В В 1800 английские ученые У. Николсон и А. Карлейль разложили В на элементы электрическим током. Таким образом, анализ и синтез В показали сложность ее состава и позволили установить для нее формулу 2. Изучение физических свойств В началось еще до установления ее состава в тесной связи с другими научно-техническими проблемами. В 1612 итальянский ученый Г. Галилей обратил внимание на меньшую плотность льда сравнительно с жидкой В как на причину плавучести льда. В 1665 голландский ученый Х. Гюйгенс предложил принять температуру кипения и температуру плавления В за опорные точки шкалы термометра. В 1772 французский физик Делюк нашел, что максимум плотности В лежит при 4°С; при установлении в конце 18 в. метрической системы мер и весов это наблюдение было использовано для определения единицы массы - килограмма. В связи с изобретением паровой машины французские ученые Д. Араго и П. Дюлонг (1830) изучили зависимость давления насыщенного пара В от температуры. В 1891-97 Д. И. дал формулы зависимости плотности В от температуры. В 1910 американский ученый П. Бриджмен и немецкий ученый Г. Тамман обнаружили у льда при высоком давлении несколько полиморфных модификаций. В 1932 американские ученые Э. Уошберн и Г. Юри открыли тяжелую В Развитие физических методов исследования позволило существенно продвинуться в изучении структуры молекул В, а также строения льда. В последние десятилетия особое внимание ученых привлекает структура жидкой В и водных растворов.
Физические свойства и строение В Важнейшие физические константы В приведены в табл. 1. О давлении насыщенного пара В при разных температурах см. в ст. Пар водяной. О полиморфных модификациях В в твердом состоянии см. в ст. Лед. Тройная точка для В, где находятся в равновесии жидкая В, лед и пар, лежит при температуре +0,01°С и давлении 6,03·10-3 атм.
Многие физические свойства В обнаруживают существенные аномалии. Как известно, свойства однотипных соединений у элементов, находящихся в одной и той же группе периодической системы изменяются закономерно. В ряду соединений элементов группы (2, 2, 2, 2) температуры плавления и кипения закономерно уменьшаются лишь у первых трех; для В эти температуры аномально высоки. Плотность В в интервале 100-4°С нормально возрастает, как и у огромного большинства других жидкостей. Однако, достигнув максимального значения 1,0000 г/см3 при +3,98°С, при дальнейшем охлаждении уменьшается, а при замерзании скачкообразно падает, тогда как почти у всех остальных веществ сопровождается увеличением плотности. В способна к значительному переохлаждению, т. е. может оставаться в жидком состоянии ниже температуры плавления (даже при -30°С). Удельная теплоемкость, удельная теплота плавления и кипения В аномально высоки по сравнению с другими веществами, причем удельная теплоемкость В минимальна при 40°С. Вязкость В с ростом давления уменьшается, а не повышается, как следовало бы ожидать по аналогии с другими жидкостями. Сжимаемость В крайне невелика, причем с ростом температуры уменьшается.
Табл. 1. - Физические свойства воды<
Свойство
| Значение |
Плотность, г/см3
|
|
лед . . . . . . . . . . . . . . . . . .
|
0,9168 (0°С)
|
жидкость . . . . . . . . . . . .
|
0,99987 (0°С)
1,0000 (3,98°С)
0,99823 (20°С)
|
пар насыщенный . . . . . .
|
0,5977 кг/м3 (100°С)
|
Темп-ра плавления . . . . .
|
0°С
|
Темп-ра кипения . . . . . . .
|
100°С
|
Критич. темп-ра . . . . . . . .
|
374,15°С
|
Критич. давление . . . . . . .
|
218,53 кгс/см2
|
Критич. плотность . . . . . .
|
0,325 г/см3
|
Теплота плавления . . . . . .
|
79,7 кал/г
|
Теплота испарения . . . . . .
|
539 кал/г (100°С)
|
Уд. теплопровод-
ность, кал/(см·сек·град)
|
|
лед . . . . . . . . . . . . . . . . . .
|
5,6·10-3 (0°С)
|
жидкость . . . . . . . . . . . .
|
1,43·10-3 (0°С)
1,54·10-3 (45°С)
|
пар насыщенный . . . . . .
|
5,51·10-5 (100°С)
|
Уд. электропровод-
ность, ом--1·см-1
|
|
лед . . . . . . . . . . . . . . . . . .
|
0,4·10-8 (0°С)
|
жидкость . . . . . . . . . . . .
|
1,47·10-8 (0°С)
4,41·10-8 (18°С)
18,9·10-8 (50°С)
|
Уд. теплоемкость
кал/(г·град)
|
|
жидкость . . . . . . . . . . . .
|
1,00 (15°С)
|
пар насыщенный . . . . . .
|
0,487 (100°С)
|
Диэлектрическая про-
ницаемость
|
|
лед . . . . . . . . . . . . . . . . . .
|
74,6 (°С)
|
жидкость . . . . . . . . . . . .
|
81,0 (20°С)
|
пар насыщенный
|
1,007 (145°С)
|
Вязкость, спз
|
|
жидкость . . . . . . . . . . . .
|
1,7921 (0°С)
0,284 (100°С)
|
Поверхностное натя-
жение жидкой во-
ды на границе с
воздухом, дин/см
|
74,64 (0°С)
62,61 (80°С)
|
Показатель прелом-
ления (D - линия
. . . . . . . . . . . . . .
|
1,33299 (20°С)
|
Скорость звука в во-
де . . . . . . . . . . . . . . . . . . .
|
1,496 м/сек (25°С)
|
Примечание: 1 кал/(см·сек·град) = 418,68 вт/(м·К); 1 ом-–1·см-–1 = 100 сим/м;
1 кал/(г·град) =.4,186 кдж (кг·К); 1 спз = 10-3н·сек/м2; 1 дин/см = 10–3н/м.
Аномалии физических свойств В связаны со структурой ее молекулы и особенностями межмолекулярных взаимодействий в жидкой В и льде. Три ядра в молекуле В образуют равнобедренный треугольник с протонами в основании и в вершине (рис. 1, а). Распределение электронной плотности в молекуле В таково (рис. 1, б, в), что создаются 4 полюса зарядов: 2 положительных, связанных с и 2 отрицательных, связанных с электронными облаками необобществленных пар электронов Указанные 4 полюса зарядов располагаются в вершинах тетраэдра (рис. 1, г). Благодаря этой полярности В имеет высокий дипольный момент (1,86 D), а четыре полюса зарядов позволяют каждой молекуле В образовать четыре водородные связи с соседними (такими же) молекулами (например, в льда).
структура обычного льда гексагональная (рис. 2), она "рыхлая", в ней много "пустот". (При плотной "упаковке" молекул В в льда его плотность составляла бы около 1,6 г/см3.) В жидкой В присущая льду связь каждой молекулы 2 с четырьмя соседними ("ближний порядок") в значительной степени сохраняется; однако "рыхлость" структуры при плавлении льда уменьшается, молекулы "дальнего порядка" попадают в "пустоты", что ведет к росту плотности В При дальнейшем нагревании В возрастает тепловое движение молекул, расстояние между ними увеличивается, т. е. происходит расширение В, которое начиная с +3,98°С уже преобладает, и поэтому далее с ростом температуры плотность В уменьшается. связи примерно в 10 раз прочнее, чем связи, обусловленные межмолекулярными взаимодействиями, характерными для большинства других жидкостей; поэтому для плавления, испарения, нагревания В необходима гораздо большая энергия, чем в случае других жидкостей, что объясняет отмеченные аномально высокие значения теплот плавления и испарения и удельной теплоемкости. С повышением температуры связи разрываются, однако определенное их число сохраняется даже при 100°С. Растворенная в органических растворителях В состоит из образовавшихся за счет связей ассоциатов (2)2.
В как растворитель. В - наиболее универсальный растворитель. Газы достаточно хорошо растворяются в В, если способны вступать с ней в взаимодействие (аммиак, сероводород, сернистый газ, двуокись Прочие газы мало растворимы в В При понижении давления и повышении температуры растворимость газов в В уменьшается. Многие газы при низких температурах и повышенном давлении не только растворяются в В, но и образуют кристаллогидраты ( криптон, сероводород, углеводороды и др.). В частности, пропан при 10°С и 0,3 мн/м2 (3 кгс/см2) дает 38·172. При уменьшении давления такие гидраты распадаются. многих газообразных веществ, образующиеся при низких температурах, содержат В в "пустотах" своих (так называемые клатраты, см. Соединения включения).
В - слабый электролит, диссоциирующий по уравнению:
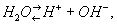
причем количественной характеристикой электролитической диссоциации В служит ионное произведение В: Кв = (Н+) (ОН-), где (Н+) и (ОН-) - концентрация соответствующих ионов в г-ион/л; Кв составляет 10-14 (22°С) и 72·10-14 (100°С), что соответствует усилению диссоциации В с ростом температуры (см. также Водородный показатель).
Будучи электролитом, В растворяет многие кислоты, основания, минеральные соли. Такие растворы проводят электрический ток благодаря диссоциации растворенных веществ с образованием гидратированных ионов (см. Гидратация). Многие вещества при растворении в В вступают с ней в реакцию обменного разложения, называемую гидролизом. Из органических веществ в В растворяются те, которые содержат полярные группы (-ОН, -2, - СООН и др.) и имеют не слишком большую молекулярную массу. Сама В хорошо растворима (или смешивается во всех отношениях) лишь в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам В присутствует практически всегда и способна резко изменять физические константы последних.
В любого природного водоема содержит в растворенном состоянии различные вещества, преимущественно соли (см., например, Жесткость воды). Благодаря высокой растворяющей способности В, получить ее в чистом виде весьма трудно. Обычно мерой чистоты В служит ее электропроводность. Дистиллированная В, полученная перегонкой обычной В, и даже повторно перегнанный дистиллят имеют электропроводность примерно в 100 раз более высокую, чем у абсолютно чистой В Наиболее чистую В получают синтезом из тщательно очищенного и в спец. аппаратуре.
В последние годы появились многочисленные сообщения о существенном изменении свойств технической и дистиллированной В после ее протекания с определенной скоростью в полях оптимальной (весьма невысокой) напряженности. Эти изменения носят временный характер и через 10-25 часов постепенно и самопроизвольно исчезают. Отмечается, что после такой "магнитной обработки" ускоряются процессы растворенных в В веществ, адсорбции, изменяется смачивающая способность В и др. Хотя теоретическое объяснение этих явлений пока отсутствует, они уже находят широкое практическое применение - для предотвращения образования накипи в паровых котлах, для улучшения процессов флотации, очистки В от взвесей и др.
Образование и диссоциация В Образование В при взаимодействии с сопровождается выделением теплоты 286 кдж/моль (58,3 ккал/моль) при 25°С (для жидкой В). Реакция 22 + 2 = 22 до температуры 300°С идет крайне медленно, при 550°С - со взрывом. Присутствие катализатора (например, позволяет реакции идти при обычной температуре. Спокойное горение в как и взрывное взаимодействие, - это цепные реакции, идущие с участием радикалов свободных.
свойства В В обычных условиях В - достаточно устойчивое соединение. Распад молекул 2 (термическая диссоциация) становится заметным лишь выше 1500°С. Разложение В происходит также под действием ультрафиолетового (фотодиссоциация) или радиоактивного излучения (радиолиз). В последнем случае, кроме 2 и 2, образуется также перекись и ряд свободных радикалов. Характерным свойством В является способность ее вступать в реакции присоединения, а также гидролитические разложения взаимодействующих веществ. Восстановители действуют на В преимущественно при высокой температуре. Только наиболее активные из них, как щелочные и щелочноземельные металлы, реагируют с В уже при комнатной температуре с выделением и образованием гидроокисей: 2 + 22 = 2 + Н2; + 22 = ()2 + 2. и взаимодействуют с В при кипячении, - после удаления с его поверхности окисной пленки. Менее активные металлы вступают в реакцию с В при красном калении: 3 + 42 = 34 + 42. Медленное взаимодействие многих металлов и их сплавов с В происходит при обычной температуре. Используя В, содержащую изотоп 18, удалось показать, что при коррозии во влажной атмосфере "ржавчина" получает именно из В, а не из воздуха (см. Коррозия металлов). Благородные металлы - а также с В не взаимодействуют.
превращает В в перекись 2 + = 22. уже при обычной температуре разлагает В: 2 + 2 2 + О. Одновременно образуются также 22, озон, окись 2 и молекулярный 2. при комнатной температуре дает с В и кислоты: 2 + 2 = + . и иод в этих условиях реагируют с В аналогичным образом. При высоких температурах (100°С для 550°С для взаимодействие идет с выделением 22 + 22 = 4 + 2. восстанавливает В и образует метафосфорную кислоту (только в присутствии катализатора под давлением при высокой температуре): 2 + 62 = 23 + 52. С и В не взаимодействует, а с при высокой температуре дает водяной газ: С + 2 = + 2. Эта реакция может служить для промышленного получения как и конверсия метана: 4 + 2 = + 32 (1200-1400°С). В взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты. Присоединение В к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов, кетонов (см. также Гидратация). В участвует во многих процессах как катализатор. Так, взаимодействие щелочных металлов или с галогенами, многие окислительные реакции не идут в отсутствие хотя бы ничтожных количеств В
В, связанную с веществом, в которое она входит (неразличимую в виде "готовых" молекул 2), называют конституционной; молекулы 2 образуются лишь в момент разложения вещества, например при сильном нагревании: ()2 = + 2. В, входящая в состав ряда веществ (например, алюминиевых квасцов 24·2 (4)3·242) и различимая в этих рентгенографически, называется или В, поглощенную твердыми веществами, имеющими большое число пор и развитую поверхность (например, активным углем), называют адсорбционной. Свободную В, заполняющую тонкие канальцы (например, в почве), называют гигроскопической (капиллярной) В Различают также структурно-свободную В, располагающуюся в пустотах некоторых структур, например в минералах. Качественно можно обнаружить В в виде конденсата, образующегося при нагревании исследуемого образца; проводя нагревание при непрерывном взвешивании, получают количественные результаты (термогравиметрический анализ). В органических растворителях В можно обнаружить по окрашиванию бесцветной сернокислой меди 4, образующей с В синий 4·52. Отделить и количественно определить В часто удается азеотропной отгонкой ее с бензолом, толуолом или другой жидкостью в виде азеотропной смеси, после расслоения которой при охлаждении измеряют объем отделившейся В
Применение В в промышленности. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение, как В В - реагент, участвующий в производстве щелочей, кислоты, спиртов, альдегидов, гашеной извести и многих других важнейших продуктов. В - необходимый компонент при схватывании и твердении вяжущих материалов - цемента, гипса, извести и т.п. Как технологический компонент для варки, растворения, разбавления, выщелачивания, В применяется в многочисленных производственных процессах. В технике В служит энергоносителем (см. Гидроэнергетика), теплоносителем (паровое отопление, водяное охлаждение), рабочим телом в паровых машинах (см. Пар водяной), используется для передачи давления (в частности, в гидравлических передачах и прессах, а также при нефтедобыче) или для передачи мощности (см. Гидропривод машин). В, подаваемая под значительным давлением через сопло, размывает грунт или породу (см. Гидромеханизация).
Требования, предъявляемые к В в промышленности, весьма разнообразны. В особой чистоты необходима для развития новейших отраслей промышленности (производство полупроводников, люминофоров, техника и др.). Поэтому особое внимание уделяется в настоящее время вопросам водоподготовки и водоочистки. По некоторым оценкам, общий объем ежегодно перерабатываемых материалов (руды, нефть, минералы и т.д.) составляет во всем мире около 4 млрд. м3 (4 км3); в то же время потребление свежей В (т. е. В из источников водоснабжения) только промышленностью СССР составило в 1965 37 млрд. м3. Стремительный рост потребления В ставит перед человечеством новую важную проблему - борьбы с истощением и загрязнением водных ресурсов планеты (см. Водные ресурсы).
Лит.: Вернадский В И., История природных вод, Избр. соч., т. 4, М., 1960; Горизонты биохимии, пер. с англ., М., 1964; Некрасов Б. В, Основы общей химии, т. 1, М., 1965; Фюрон Р., Проблемы воды на земном шаре, пер. с франц., М., 1966; Круговорот воды, М., 1966; Паундер Э., Физика льда, пер. с англ., М., 1967; Виноградов А. П., Введение в геохимию океана, М., 1967; Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957; Изотопный анализ воды, 2 изд., М., 1957; Термодинамика и строение растворов, М., 1959; Краткая энциклопедия, т. 1, М., 1961, с. 605-14.
В Л. Василевский.
В в организме - основная среда (внутриклеточная и внеклеточная), в которой протекает обмен веществ у всех растений, животных и микроорганизмов, а также субстрат ряда ферментативных реакций. В процессе фотосинтеза В вместе с углекислым газом вовлекается в образование органических веществ и, таким образом, служит материалом для создания живой материи на Земле.
Табл. 2. - Содержание воды в различных организмах, их органах и тканях<
Организмы, органы, ткани
|
Содержание воды, %
|
Растения (наземные)
|
|
верхушка растущего побега
|
91-93
|
листья . . . . . . . . . . . . . . . . .
|
75-86
|
Семена злаков . . . . . . . . . . .
|
12-14
|
Водоросли . . . . . . . . . . . . . . .
|
90-98
|
Мхи, лишайники . . . . . . . . . .
|
5-7
|
Медузы . . . . . . . . . . . . . . . . .
|
95–98
|
Дождевые черви . . . . . . . . . .
|
84
|
Насекомые
|
|
взрослые . . . . . . . . . . . . . . .
|
45-65
|
личинки . . . . . . . . . . . . . . . .
|
58-90
|
Рыбы . . . . . . . . . . . . . . . . . . .
|
70
|
Млекопитающие (в т. ч.
человек) . . . . . . . . . . . . . . . .
|
63-68
|
скелет . . . . . . . . . . . . . . . . .
|
20-40
|
мышцы . . . . . . . . . . . . . . . . .
|
75
|
печень . . . . . . . . . . . . . . . . .
|
75
|
Мозг человека . . . . . . . . . . . .
|
|
серое вещество . . . . . . . . . .
|
84
|
белое вещество . . . . . . . . . .
|
72
|
В обеспечивает тургор тканей, перенос питательных веществ и продуктов обмена (кровь, лимфа, сок растений), физическую терморегуляцию (см. Транспирация, Потоотделение) и другие процессы жизнедеятельности. Жизнь, вероятно, возникла в водной среде. В ходе эволюции различные водные животные и водные растения вышли на сушу и приспособились к наземному образу жизни; тем не менее и для них В - важнейший компонент внешней среды. Жизнь без В невозможна. При недостатке В жизнедеятельность организмов нарушается. Лишь покоящиеся формы жизни - споры, семена - хорошо переносят длительное обезвоживание. Растения при отсутствии В увядают и могут погибнуть, но чувствительность различных растений к недостатку В неодинакова (см. Засухоустойчивость, Ксерофиты, Мезофиты). Животные, если лишить их В, быстро погибают: упитанная собака может прожить без пищи до 100 дней, а без В - менее 10. Содержание В в организмах велико (см. табл. 2).
В жидкостях организма - межклеточных пространствах, лимфе, крови, пищеварительных соках, соке растений и др. - содержится свободная В В тканях животных и растений В находится в связанном состоянии - она не вытекает |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 08.03.2026 06:33:36
|

|

|
 |
|

|
 |
 |
 |
|