
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Азота окислы | окислы (далее А) соединения с Известны 2, , 23, 2 (и его димер 24), 25; есть сведения о существовании 3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе — при электроразряде из смеси с образуется окись , которая при охлаждении переходит в 2. Другие А получают косвенным путем. 25 — твердое вещество; остальныеА при обычных условиях газообразны.
Закись 2 — бесцветный газ со слабым приятным запахом и сладковатым вкусом; вдыхание смеси воздуха с 2 вызывает состояние, напоминающее опьянение (отсюда название — веселящий газ). Плотность при 0°С и 101 325 н/м2 (760 мм рт. ст.) 1,9804 кг/м3, tкип — 89,5°С, tпл — 102,4°С. 1 объем 2 при 5° растворяет 1,048 объема 2. 2 с водой, растворами кислот и щелочей не реагирует, не окисляется. Выше 500° разлагается: 22 = 22 + 2; поэтому при повышенных температурах действует как сильный окислитель и поддерживает горение. Получают 2 термическим разложением нитрата аммония: 43=2+ 22. В медицине служит для общей анестезии.
Окись — бесцветный газ, буреющий при соприкосновении с воздухом вследствие окисления до 2. Плотность при 0°С и 101 325 н/м2 (760 мм рт ст) 1,3402 кг/м3, tкип—151,8°С, tпл—163,6°С. В воде мало растворима (0,0738 объема в 1 объеме 2 при 0°С). С водой, кислотами и щелочами не взаимодействует. Образует многочисленные продукты присоединения, например нитрозилхлорид . Получают действием разбавленной кислоты на некоторые металлы, например: 3 + 83= 3(3)2 + 42 + 2. Окись — важный полупродукт окисления аммиака при получении азотной кислоты.
ангидрид (трехокись 23 — в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
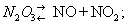
Около 3,5°С кипит с разложением, при 25° содержит только 10% недиссоциированного 23. При низкой температуре может быть получен в виде темно-голубой жидкости, при сильном охлаждении — светло-голубой массы с tпл —102°С. С водой образует азотистую кислоту: 23 + 2 = 22, со щелочами — соли (см. Нитриты). 23 получают по реакции: 24+ 2 = 223; практического применения не находит.
Двуокись 2 — бурый газ с удушливым запахом, при 21,15° — буро-красная жидкость, бледнеющая при дальнейшем охлаждении из-за образования четырехокиси 24 , tотв —11,2°С. Взаимодействует с водой с образованием кислоты и окиси 32 + 2 = 23 + ; со щелочами образует нитраты и нитриты. Двуокись — сильный окислитель; в токе 2 энергично сгорают сера, органические соединения. В промышленности 2 получают окислением при производстве кислоты, в лаборатории — термическим разложением некоторых нитратов: 2(3)2 = 2 + 2 + 42. Применяют 2 как нитрующий агент (см. Нитрование органических соединений).
ангидрид (пятиокись 25 — бесцветные очень летучие Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая кислоту: 25 +Н2 = 23, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 23 + 25 = 25+ 23. Практического применения не находит. Все А физиологически активны.
Лит. см. при ст. Азот, Азотная кислота. |
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 01.03.2026 20:46:22
|

|

|
 |
|

|
 |
 |
 |
|