
|

|
Большая Советская Энциклопедия (цитаты)
|

|

|
 |
Ван-дер-Ваальса уравнение | Ван-дер-Ваальса уравнение (далее В)одно из первых уравнений состояния реального газа, предложенное голландским физиком Я. Д. Ван-дер-Ваальсом (1873):
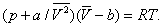
Здесь: р — давление газа; Т — его температура; 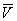 — объем одного моля вещества; R — универсальная газовая постоянная; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член — объем одного моля вещества; R — универсальная газовая постоянная; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член 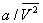 , имеющий размерность давления, учитывает притяжение между молекулами газа за счет ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объем молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших , имеющий размерность давления, учитывает притяжение между молекулами газа за счет ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объем молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших 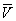 можно пренебречь обеими поправками и Ван-дер-Ваальса уравнение переходит в уравнение состояния идеального газа (см. Клапейрона уравнение). можно пренебречь обеими поправками и Ван-дер-Ваальса уравнение переходит в уравнение состояния идеального газа (см. Клапейрона уравнение).
Ван-дер-Ваальса уравнение является приближенным и количественно описывает свойства реальных газов лишь в области высоких температур и низких давлений. Однако качественно оно позволяет описывать поведение газа при высоких давлениях, конденсацию газа в жидкость и критическое состояние (см. также Уравнение состояния).
На рис. изображено семейство изотерм (кривых зависимости р от  при постоянной температуре), рассчитанных по Ван-дер-Ваальса уравнение Это уравнение, кубическое относительно при постоянной температуре), рассчитанных по Ван-дер-Ваальса уравнение Это уравнение, кубическое относительно 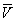 , имеет три корня. При низких температурах все три корня — действительные, а выше определенной температуры Тк, называемой критической, остается лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк — в трех состояниях (двух стабильных — жидком , имеет три корня. При низких температурах все три корня — действительные, а выше определенной температуры Тк, называемой критической, остается лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк — в трех состояниях (двух стабильных — жидком 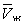 и газообразном и газообразном 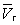 — и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объемов. Точки прямой ac отвечают равновесию жидкости и ее насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba ("правило моментов"). Равновесию фаз при определенной температуре соответствуют давление насыщенного пара рнп и интервал объемов от — и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объемов. Точки прямой ac отвечают равновесию жидкости и ее насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba ("правило моментов"). Равновесию фаз при определенной температуре соответствуют давление насыщенного пара рнп и интервал объемов от 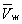 до до 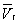 . При более низких давлениях (правее . При более низких давлениях (правее 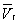 ) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объема при увеличении давления. Совокупность точек а, a", а"... и с, c", с"... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объем (Тк, рк, ) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объема при увеличении давления. Совокупность точек а, a", а"... и с, c", с"... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объем (Тк, рк, 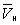 ) имеют значения, характерные для каждого вещества. Однако, если в Ван-дер-Ваальса уравнение ввести относительные величины: Т/Тк, Р/рк и ) имеют значения, характерные для каждого вещества. Однако, если в Ван-дер-Ваальса уравнение ввести относительные величины: Т/Тк, Р/рк и 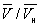 , то можно получить так называемое приведенное Ван-дер-Ваальса уравнение, которое является универсальным, то есть не зависит от индивидуальных свойств вещества. , то можно получить так называемое приведенное Ван-дер-Ваальса уравнение, которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
Лит.: Штрауф Е. А., Молекулярная физика, Л. — М., 1949; 3оммерфельд А., Термодинамика и статистическая физика, пер. с нем., М., 1955: Вукалович М. П. и Новиков И. И., Уравнение состояния реальных газов, М. — Л., 1948.
А. А. Лопаткин.
|
Для поиска, наберите искомое слово (или его часть) в поле поиска
|

|
 |
 |
 |

|

|
Новости 08.03.2026 05:14:57
|

|

|
 |
|

|
 |
 |
 |
|